翻訳|oxygen
精選版 日本国語大辞典 「酸素」の意味・読み・例文・類語
さん‐そ【酸素】
改訂新版 世界大百科事典 「酸素」の意味・わかりやすい解説
酸素 (さんそ)
oxygen
周期表第ⅥB族に属する酸素族元素の一つ。自然界に最も豊富に存在し,おもにケイ素,アルミニウムの酸化物として地殻の重量の46.4%を占めている。空気には20.91容量%,水には88.8重量%,また人体には約65%の酸素が含まれている。空気中の酸素は燃焼や動物の呼吸作用によって消費されるが,一方,植物の同化作用によって二酸化炭素が分解されて酸素が供給され,バランスが保たれている。
イギリスのJ.プリーストリーは1774年,赤降汞(せきごうこう)(酸化水銀(Ⅱ)HgO)を大きなレンズ(日取りレンズ)を用いて太陽光によって加熱し新しい気体を得た。
HgO─→Hg+1/2O2
この気体は燃焼を支える力が強く,動物は普通の空気の中よりもこの気体の中のほうがずっと長く生きることがわかった。フロギストン説の強力な支持者であったプリーストリーはこの新気体を〈脱フロギストン空気〉と名づけたが,これは,燃焼を支えなくなった空気は完全にフロギストンで満たされてしまったものと考えたことから命名されたものである。それと同じころスウェーデンのK.W.シェーレも,硝石を強く加熱するか軟マンガン鉱を濃硫酸で処理して得られる気体を〈火の空気〉と名づけていた。これが現在の酸素であり,プリーストリーとシェーレが酸素の発見者であるとされている。74年,プリーストリーから脱フロギストン空気について説明を受けたA.L.ラボアジエは,この気体を〈きわめて呼吸に適した空気〉と呼んで,さらに研究を進め,木炭,リン,硫黄などの燃焼現象が,これら可燃性物質と酸素とが結合する現象であることを明らかにし,フロギストン説を否定した。そして81年,ラボアジエは酸素中での燃焼生成物が酸の性質をもっていると主張し,この元素をギリシア語のoxys(酸)とgennaō(生ずる)からoxygèneと命名した。これから英語oxygenがつくられた。ラボアジエはさらに89年,彼の著書《化学要論》の中で酸素を中心においた新しい燃焼理論を詳しい実験事実をあげて展開し,以後の化学に決定的な影響を与えた。このことはしばしば化学革命とも呼ばれている。
製法
実験室で酸素を発生させるには3~5%の過酸化水素H2O2水溶液に二酸化マンガンMnO2を触媒として加えて分解するのが簡単で便利である。
2H2O2─→2H2O+O2
塩素酸カリウムKClO3を熱分解する方法もよく知られているが,有機物が存在すると爆発するので注意が必要である。
2KClO3─→2KCl+3O2
この反応でも二酸化マンガンが触媒となり,150℃で反応はほどよく進行する。過マンガン酸カリウムKMnO4の熱分解によれば,より純粋な酸素を得ることができる。
2KMnO4─→K2MnO4+MnO2+O2
工業的には,液体空気の分留により窒素と同時に製造される。低純度,小容量の製造には,モレキュラーシーブにより空気から吸着・脱着を利用して酸素を分離するか,水の電気分解で製造される。
性質
単体としての酸素には二つの同素体がある。普通には安定型の二原子分子気体O2として存在する。O2は通常無色無臭の気体であるが,液体および固体では淡青色である。水には溶けにくく,水100mlに対し1気圧25℃で3.16mlの溶解度を示すが,海水中では溶解度は若干下がる。この溶存酸素は魚貝類や好気性微生物にとってきわめて重要である。酸素気体中で無声放電すると三原子分子のオゾンO3が生ずる。存在量の少ない同位体17Oあるいは18Oは水の分別蒸留によって濃縮することができ,18O=97atom%および17O=4atom%まで濃縮されたものは酸素の関与する反応機構を研究するためのトレーサーとして用いられる。二原子分子は117kcal/molというかなり高い解離熱をもち,安定である。また分子は常磁性で,不対電子の存在が認められるが,これは分子軌道関数理論によって,O-O結合中の反結合性軌道に電子が存在することで説明されている。普通の二原子分子では二つの酸素原子の結合距離は1.21Åであるが,これに電子を付加させると結合間隔は増大し(O2⁻で1.26Å,O22⁻で1.49Å),また電子を失うと結合距離が短くなる(O2⁺で1.12Å)ことが知られている。このことは電子を付加したり失ったりする分子軌道が反結合性のπ*であることに注目するとよく理解できる。
酸素は化合物中で種々の方法で安定な閉殻電子配置に達する。(1)電子を二つ得て酸化物イオンO2⁻をつくる(CaOなど多くの金属のイオン性酸化物がこれに相当する)。(2)二つの共有(一重)結合(水H2O,アルコールROH,エーテルR-O-Rなど),または一つの二重結合(二酸化炭素O=C=O,アルデヒド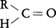 ,ケトン,
,ケトン,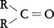 など)をつくる。(3)電子一つを得,さらに一つの一重結合をつくる(水酸化物イオンOH⁻など)。(4)三つあるいは四つの共有結合をつくる(R2OH⁺など)。
など)をつくる。(3)電子一つを得,さらに一つの一重結合をつくる(水酸化物イオンOH⁻など)。(4)三つあるいは四つの共有結合をつくる(R2OH⁺など)。
酸素はヘリウム,ネオン,アルゴンを除いたすべての元素と化合物をつくり,しかもハロゲン元素,少数の貴金属元素,希ガス元素を除いたすべての元素と常温あるいは高温で酸素分子O2と直接化学反応して酸化物をつくる。たとえば,
C+O2─→CO2
2Ca+O2─→2CaO
S+O2─→SO2
4Al+3O2─→2Al2O3
3Fe+2O2─→Fe3O4
4P+5O2─→2P2O5
などであり,一般にこれらの酸化反応は発熱を伴い,場合によっては燃焼を起こす。生成する酸化物は含まれる結合が上記(1)の場合に従うイオン性であるか,(2)の場合の共有結合性であるかによって,その物理的・化学的性質は大きく異なる。無色固体のCaOはイオン性であり2580℃の高い融点をもつ。一方,SO2は共有結合性分子であり無色の気体である。主として共有性の結合によって多くの種類のオキソ酸およびオキソ陰イオンが存在する。たとえばSO42⁻,NO3⁻,MnO4⁻,CO32⁻等の単量体や,Cr2O72⁻,P2O74⁻などの酸素の橋架けによるポリ陰イオンなどもある。
遷移金属錯体のうちで分子状酸素O2と結合して可逆的担体として働くものがある。たとえばきわめて簡単なものとしては1963年バスカL.Vaskaによってはじめて合成された[IrCl(CO)(Pph3)2]があり,常温において加圧下溶液中でO2を取り込む。タンパク質分子に含まれる金属錯体は酸素担体として働き,生命過程,とくに呼吸作用に欠くことのできないものがある。ヘモグロビンやヘモシアニンなどがこれである。
用途
酸水素炎,酸素アセチレン炎などの発生する高温を利用して,造船,機械など各種工業における金属の溶接,切断などに使われる。また鉄鋼業での酸素製鋼,各種化学工業での酸素酸化など酸化剤として用いられる。そのほか酸素吸入などの医療用,活性汚泥法水処理の際の曝気(ばつき)用にも用いられている。
液体酸素
液化した酸素をとくに液体酸素といっている。純粋な液体酸素は比重1.141,沸点-182.96℃の透明な淡青色液体。空気を液化して液体空気とし,これに少し加圧した空気を通ずると,窒素の分留が促進され,窒素が放出されるので,酸素95%以上の液体が得られる。工業的には通常これを液体酸素といっている。低温で気化するので,貯蔵や取扱いには断熱容器,多くデュワー瓶(大量では金属製,少量ではガラス製)が用いられる。低温を得るための冷却用として用いることができるが,可燃性物質とくに有機物などが投入されると爆発するので危険である。この強力な爆発性を利用して,液体酸素を炭素分に富む吸収剤(たとえば木炭など)に吸収させて液体酸素爆薬などとして用いられる。また大型ロケットの推進薬の酸化成分としても用いられる。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「酸素」の意味・わかりやすい解説
酸素
さんそ
oxygen
周期表第16族に属し酸素族元素の一つ。
酸素の発見
古代、空気は元素であると考えられていたが、10世紀ごろからは混合物であるとされ始めた。そして17世紀には空気が2種類の気体の集まりであり、一つは硝石から得られ、もう一つは不活性な気体であることが明らかにされるようになった。スウェーデンのシェーレは1771年ころ硝酸カリウム(硝石)を熱して、イギリスのプリーストリーは1774年に集光レンズで太陽光線を集め、ガラス鐘の中の酸化水銀に当てて酸素を取り出した。しかし、2人ともフロギストン説(物が燃えるのはフロギストンが逃げていくという説)の信奉者であったため、新ガスが普通の空気に比べ著しく燃焼を支持することから、シェーレは「火の空気」、プリーストリーは「脱フロギストン空気」とよぶにとどまった。フランスのラボアジエは、金属を熱するときの重量増加は空気の一部分が固定されるためと考え、プリーストリーの実験と逆に、密閉器中で水銀を空気と熱して酸化水銀をつくり、空気の減りぐあいを調べ、さらに酸化水銀を熱して酸素を得ることを確認し、フロギストン説とまっこうから対立する新燃焼説を打ち立てた。ラボアジエは、1777年初めてこれが元素単体であることを明らかにして、この新しい気体中での燃焼生成物の多くが酸の性質を示すことから、ギリシア語のoxys(酸味のある)とgennao(生じる)からoxygèneと命名した。元素としての酸素の発見は化学史上きわめて重要なできごとで、これにより現代化学の礎(いしずえ)が築かれた。日本では宇田川榕菴(うだがわようあん)の『舎密開宗(せいみかいそう)』(1837)に「阿幾舎厄紐母(オキセイゲニユム)、酸素」と記されている。
[守永健一・中原勝儼]
存在
岩石中に約50重量%、水には約89重量%ほど含まれ、化合物として地殻(厚さ16キロメートル)、水圏中でもっとも多い元素である。また、遊離の状態すなわち酸素分子として大気中に21容量%も含まれる。宇宙では水素、ヘリウムに次いで3番目に多い。地球が生成したとき、酸素はすべて溶融状態で固定されていたと考えられ、やがて出現した緑色植物の光合成の副産物として供給され、現在のような大気ができたのは10億年前といわれている。大気中の酸素の同位体組成は16O:99.76%、18O:0.20%、17O:0.04%である。90%(原子数)以上に濃縮された18Oは重酸素とよばれ、トレーサー実験に利用される。
[守永健一・中原勝儼]
製法
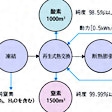
工業的に、酸素は液体空気の分留により窒素と同時に製造される。小型の製造法として、空気からモレキュラーシーブによる吸脱着を利用した分離法や、水電解による方法がある。実験室では、塩素酸カリウムに触媒として半量くらいの二酸化マンガンを混ぜて熱する(有機物が混入すると爆発しやすい)。ほかに、二酸化マンガンを触媒とする過酸化水素の分解、あるいは水の電解、また過マンガン酸カリウムを真空中加熱分解させる方法がある。市販品は液体酸素としてタンクローリーあるいはボンベ入りで取り扱われ、ボンベの色は黒である。全低圧式の酸素と窒素の製造工程についてはを参照。
[守永健一・中原勝儼]
性質と用途
常温常圧で無色、無味、無臭の気体。二原子分子O2は2個の不対電子をもち常磁性である。無声放電または遠紫外線の照射でオゾンO3を生じる。きわめて活性な元素で、軽い希ガスを除きすべての元素との化合物が知られ、多くの元素と直接反応する。たとえば、炭素、硫黄(いおう)、リンなどは酸素中で激しく燃え、アルミニウム、鉄、銅なども粉末状態では閃光(せんこう)を発して燃える。希ガス、ハロゲン、金、白金などの貴金属とは直接反応しない。動植物の生活と密接な関係があり、酸素なくしては生命は保たれない。
最大の用途は鉄鋼業における酸素製鋼で、ほかに化学工業・石油化学工業での酸素酸化、造船・機械工業での酸素切断、溶接用、医療用(酸素吸入)、活性汚泥法による水処理の曝気(ばっき)用などがある。
[守永健一・中原勝儼]
酸素(データノート)
さんそでーたのーと
酸素
元素記号 O
原子番号 8
原子量 15.9994±3
酸素分子 O2
気体,無色
液体,淡青
固体,淡青
融点 -218.4℃
沸点 -182.96℃
比重 液体,1.141(測定温度-183℃)
固体,1.426(測定温度-252℃)
密度 気体,1.4289g/dm3(0℃,1気圧)
結晶系 α;単斜
β;斜方
γ;立方
溶解度 4.89mL/100mL(水0℃)
1.70mL/100mL(水100℃)
臨界温度 -118.8℃
臨界圧 49.7気圧
元素存在度 宇宙 2.36×107(第3位)
(Si106個当りの原子数)
地殻 46.4%(第1位)
海水 0.88×109μg/dm3
化学辞典 第2版 「酸素」の解説
酸素
サンソ
oxygen
O.原子番号8の元素.電子配置[He]2s22p4の周期表16族元素(カルコゲン).原子量15.9994(3).質量数16(99.757(16)%),17(0.038(1)%),18(0.205(14)%)の安定同位体と,14,15,19,20,21,22の放射性同位体が知られている.半減期122.2 s で軌道電子捕獲により 15N にかわる 15O は,PETによる酸素代謝,血流量診断用に使われる.1771年,K.W. Scheele(シェーレ)により,1774年,J. Priestley(プリーストリー)により発見されたことになっているが,古くからその存在は知られていた.A.L. Lavoisier(ラボアジエ)が1789年,著書Traité élémentaire de chimieのなかで,この元素が多くの物質と化合して「酸を発生させる」として,ギリシア語の“酸”οξ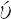
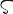 (oxys)と“産み出す”γεινομαι(geinomai)からつくった元素名.日本語の元素名も酸のもと(素)の意味で,蘭学者・宇田川榕菴が「舎密開宗」(天保8年,1837年)のなかで使っている.
(oxys)と“産み出す”γεινομαι(geinomai)からつくった元素名.日本語の元素名も酸のもと(素)の意味で,蘭学者・宇田川榕菴が「舎密開宗」(天保8年,1837年)のなかで使っている.
地殻中の存在度453000 ppm.宇宙でも水素,ヘリウムについで多く存在する(原子数比).大気中の存在度21%.酸素は生物の呼吸に不可欠で,17% 以下では呼吸が困難となり,25% 以上では多くの有機化合物の引火性が高くなる.原始大気中には存在せず,約35億年前に海中のラン藻植物の光合成により生成したとされる.通常は O2 として存在するが,オゾン O3 としても微量存在する.DNAの成分元素で,生体に不可欠の元素.人体の質量の半分以上が酸素である.工業的には,液体空気の分留,水の電解で得られる.実験室では,過マンガン酸カリウムの熱分解,過酸化水素水(硫酸酸性)と強酸化剤との反応,過酸化水素水を分解するなどの方法がある.無色,無臭の気体.液体と固体は淡青色,固体にはα,β,γの三変態がある.液体の密度1.149 g cm-3(-182.82 ℃).融点-218.3 ℃,沸点-182.82 ℃.臨界温度-118.57 ℃.第一イオン化エネルギー1313.7 kJ mol-1(13.618 eV).酸化数-2.単体は二原子分子で,常磁性を示す.基底状態は三重項である.O-O0.1207 nm.化学的に非常に活性で,ほとんどの元素と化合物をつくる.貴金属,ハロゲン元素を直接酸化しないが,希ガス元素のうち,Xeとは酸化物([別用語参照]キセノン化合物)をつくる.最大の用途は,鉄鋼用で高炉,転炉,電気炉で脱炭素,脱硫などのために吹き込まれる.機械・建設業で鋼材の溶接・切断に,製紙業ではパルプ漂白に,そのほか医療用,ロケットの推進剤,排水処理などに使われる.日本の年間使用量は約20億 m3.[CAS 7782-44-7]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「酸素」の意味・わかりやすい解説
酸素【さんそ】
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「酸素」の意味・わかりやすい解説
酸素
さんそ
oxygen
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「酸素」の解説
酸素
世界大百科事典(旧版)内の酸素の言及
【地質時代】より
…また,マントル対流の動きはつねに一定の速さではなく,マントル対流が活発になると海底を強く押し上げるため,海水が陸地にあふれて大陸に海が入り込み,逆に対流が穏やかになると海水が大陸から退いて,それがまた石油や石炭などの資源の生成に大きく関与しているともいわれている(図4)。
[酸素を含む大気]
現在,地球の大気の21%が酸素であるが,多くの生物の生命を支えるこの酸素が,じつは地球に栄えた植物の光合成作用によって大気に加えられたことが明らかになった。地球の大気は,マントルの中の揮発性のガスが貯積されたものと考えられている。…
※「酸素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
敵を欺くために、自分の身や味方を苦しめてまで行うはかりごと。また、苦しまぎれに考え出した手立て。苦肉の謀はかりごと。「苦肉の策を講じる」...