精選版 日本国語大辞典 「二酸化硫黄」の意味・読み・例文・類語
にさんか‐いおうニサンクヮいわう【二酸化硫黄】
- 〘 名詞 〙 =ありゅうさんガス(亜硫酸瓦斯)〔新語常識辞典(1936)〕
改訂新版 世界大百科事典 「二酸化硫黄」の意味・わかりやすい解説
二酸化硫黄 (にさんかいおう)
sulfer dioxide
化学式SO2。俗に亜硫酸ガス,無水亜硫酸と呼ばれる。硫黄あるいは硫黄化合物を燃焼させると生ずるが,実験室では亜硫酸ナトリウムまたは亜硫酸水素ナトリウム水溶液に強酸を加えて発生させる。
Na2SO3+H2SO4─→Na2SO4+SO2+H2O
液化したものをボンベに充てんして市販される。
性質
自燃性も助燃性もない無色,刺激臭のある気体。融点-75.5℃,沸点-10℃。水に対する溶解度22.8g/100ml(0℃),4.5g/100ml(50℃)。水溶液は亜硫酸を生ずるため酸性を呈する。メチルアルコール,エチルアルコール,エーテル,クロロホルム,硫酸,酢酸に溶ける。気体分子の構造は,二等辺三角形の折線形でS-Oの結合間隔1.432Å,結合角∠OSO=119.5°。この分子構造は-180℃における結晶中でも保たれる。共有性の強い無機化合物や多くの有機化合物をよく溶かし,非水溶媒としても重要である。酸化作用と還元作用を示す。
SO2+2H2S─→3S+2H2O
(酸化作用)
2KMnO4+5SO2+2H2O─→K2SO4+2MnSO4+2H2SO4
(還元作用)
二酸化硫黄は有毒であり,環境基準の設定されている代表的大気汚染物質である。大気中に排出されたSO2は浮遊粒子と共存すれば表面の水膜中で酸化されて硫酸ミストとなり,SO2単独よりもはるかに大きな毒性をもつことになる。環境基準は1日平均0.04ppm,1時間平均0.1ppm以下とされている。硫黄酸化物は各地域ごとに厳しく規制されており,労働衛生における許容濃度は5ppmである。
黄鉄鉱,黄銅鉱,セン亜鉛鉱などの硫化物鉱石を焙焼(ばいしよう)して生ずる製錬排ガス中には2~12%の二酸化硫黄が含まれる。たとえば黄鉄鉱の場合,
FeS2─→FeS1+x+1/2(1-x)S2
で,xは温度によって異なる値をとるが,900℃辺りではx=0となる。遊離した硫黄とFeS1+xが酸素と反応してSO2とFe2O3を生ずる。このときFe2O3が触媒となって,生成したSO2の2~10%は三酸化硫黄に酸化され,硫酸ミスト発生の原因となる。重油には2%程度の硫黄が含まれるので,これを燃料としているボイラーの排煙中にも1000~2000ppmの濃度のSO2が含まれる。環境保全と硫黄の有効利用の立場から,これらの排ガスからSO2の除去,回収が行われている。SO2は大気汚染による人間の呼吸器に対する直接的被害だけでなく,最近大都市周辺地域に降る酸性雨の原因となり,この影響で湖沼や土壌のpHが下がって森林や生物などの自然環境に大きな変化をもたらしている。
→排ガス処理
用途
硫酸の原料として重要である。種々の方法で得たSO2を触媒により三酸化硫黄SO3とし,これを希硫酸に吸収させて濃硫酸あるいは発煙硫酸が製造されている。また酸化作用を利用して,紙パルプ,木材,繊維,食品,油脂などの漂白に使用される。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「二酸化硫黄」の解説
二酸化硫黄
ニサンカイオウ
sulfur dioxide
SO2(64.07).亜硫酸ガス(sulfurous acid gas)は二酸化硫黄の気体の通俗名.天然には,火山ガス,鉱泉中に少量含まれている.工業的には,硫黄,硫化水素,黄鉄鉱FeS2などの金属硫化物の燃焼によって製造される.実験室では,市販のボンベ入り二酸化硫黄を使用するか,固体亜硫酸塩の硫酸分解,または銅と濃硫酸との熱時反応により発生させる.気体は無色.刺激臭があり有毒.液体は無色透明.固体は白色.密度1.46 g cm-3(-10 ℃,液体),2.927 g dm-3(気体).融点-75.48 ℃,沸点-10.02 ℃.水に易溶,アセトン,エタノール,四塩化炭素,ベンゼン,メタノール,酢酸,エーテル,クロロホルムに可溶.気体は折れ線形SO2分子からなり,S-O0.14308 nm.∠O-S-O119.32°.双極子モーメント1.59 D.
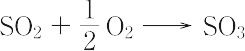
の反応速度は遅く,400~450 ℃ で白金または五酸化二バナジウムなどの触媒を用いないと,収率よく酸化されない.水が存在すれば,室温でも酸化される.二酸化硫黄は酸化剤としても還元剤としてもはたらく.硫化水素と反応し,硫黄と水とを生成する.二酸化硫黄の水溶液は亜硫酸H2SO3水溶液とよばれてきたが,H2SO3分子は水溶液中に存在せず,水和した二酸化硫黄分子が存在するのみである.液体二酸化硫黄は非水溶媒として多くの無機,有機化合物を溶かし,NMR(核磁気共鳴)の研究,合成などに用いられる.もっとも強い酸HSO3F-SbF5(super acid)の溶媒としても使われる.硫酸製造の原料,殺菌剤,殺虫剤,浮選,漂白剤,還元剤,農薬,医薬品,酸化防止剤などに用いられる.二酸化硫黄は腐食性の強い有毒物質で,結膜炎を起こしたり,上気道をおかすために,せき,呼吸困難,胸痛などの症状を引き起こす.労働衛生上の許容濃度は5 ppm( = 13 mg SO2/m3)である.植物では1 ppm 以下でも光合成が阻害されるため,大きな影響が出る.二酸化硫黄は空気中の酸素,水分,じんあいにより酸化されて硫酸になり,さらにその危険度を増す.また,緑青(ろくしょう)のように各種の金属表面を腐食する.大気中の二酸化硫黄の環境基準は,1日平均値が0.04 ppm 以下であり,かつ1時間値が0.1 ppm 以下であること,とされている.[CAS 7446-09-5][別用語参照]二酸化硫黄の微量分析,大気汚染
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「二酸化硫黄」の意味・わかりやすい解説
二酸化硫黄
にさんかいおう
sulfur dioxide
硫黄と酸素の化合物。俗称亜硫酸ガス、無水亜硫酸。天然に火山ガスや鉱泉などに含まれる。工業的には硫黄、硫化鉱などを過剰の空気中で焙焼(ばいしょう)する。実験室では濃硫酸を炭素、硫黄、銅と熱する。亜硫酸水素ナトリウムNaHSO3のような亜硫酸塩を酸で分解すれば純粋なものが得られる。刺激臭のある無色の気体。粘膜を冒し有毒である。分子は折れ線形。水に易溶で水溶液は亜硫酸H2SO3を生じている。白金アスベストまたは酸化バナジウム(Ⅴ)V2O5を触媒として酸素と結合し、三酸化硫黄SO3となる。炭素があると塩素により塩化スルフリルSO2Cl2を生じる。また五塩化リンにより塩化チオニルSOCl2を生じる。水溶液中では還元剤として、過マンガン酸塩、二クロム酸塩、過酸化水素、ハロゲン、鉄(Ⅲ)塩などにより硫酸に酸化され、酸化マンガン(Ⅳ)によりジチオン酸に酸化される。漂白・殺菌作用はこの強い還元作用による。硫化水素には酸化剤として作用し、硫黄を遊離する。高純度のものは液化され、液化二酸化硫黄としてボンベに入れて市販されている。液体は液体アンモニアと並んで以前から多くの無機化合物を溶かすので非水溶媒として研究された。硫酸(硝酸式および接触式)製造、亜硫酸ナトリウム製造のほかに、石油精製、漂白剤(パルプなど)、食品加工、農薬、浮遊選鉱、溶媒としても用いられる。気体は露出している粘膜をすべて刺激する。濃い気体を吸入すると、鼻汁、痰(たん)、咳(せき)が出て呼吸困難となる。気管支炎、肺水腫(すいしゅ)、肺炎などになることもある。空気中に3~5ppm存在すると臭いと感じ、長時間耐えられる限度は400~500ppm。製錬所や石油・石炭などを燃料とする工場の排煙などにかなりの量が含まれており、都市空気の汚染源、また酸性雨の要因として注目されている。
[守永健一・中原勝儼]
二酸化硫黄(データノート)
にさんかいおうでーたのーと
二酸化硫黄
気体分子の構造
SO2
式量 64.1
融点 -75.5℃
沸点 -10℃
比重 液体 1.46(測定温度-10℃)
(密度) 気体 2.927g/dm3(0℃,1気圧)
溶解度 22.8g/100mL(水0℃)
臨界温度 157.2℃
臨界圧 77.7気圧
蒸発熱 5.96kcal/mol
栄養・生化学辞典 「二酸化硫黄」の解説
二酸化硫黄
ブリタニカ国際大百科事典 小項目事典 「二酸化硫黄」の意味・わかりやすい解説
二酸化硫黄
にさんかいおう
「硫黄酸化物」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の二酸化硫黄の言及
【硫黄酸化物】より
…硫黄の酸化物の総称であるが,おもに,硫黄Sを含んだ化石燃料の燃焼により二酸化硫黄SO2(亜硫酸ガス)や三酸化硫黄SO3の形で発生し,エーロゾルに吸着したり硫酸などの酸化物となって大気中に存在する。SO2は300~500ppmの濃度で短時間のうちに胸痛,意識混濁などの中毒症状を生じさせ,1.6ppmで健康人の上気道粘膜を刺激して可逆的な気管支収縮を発生させる。…
※「二酸化硫黄」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
1 花の咲くのを知らせる風。初春から初夏にかけて吹く風をいう。2 ⇒二十四番花信風...

