精選版 日本国語大辞典 「硝酸カリウム」の意味・読み・例文・類語
しょうさん‐カリウムセウサン‥【硝酸カリウム】
日本大百科全書(ニッポニカ) 「硝酸カリウム」の意味・わかりやすい解説
硝酸カリウム
しょうさんかりうむ
potassium nitrate
カリウムの硝酸塩。天然には硝石として産出するが、その量はあまり多くないので、需要の大部分は工業的に製造されたものでまかなわれる。古くはチリ硝石(硝酸ナトリウム)が主要原料であったが、近年、アンモニア製造工場の大型化に伴って、硝酸、硝酸アンモニウムなどが比較的安価に生産されるようになったので、これらを原料とした新しい製造法が開発された。
硝酸を水酸化カリウムや炭酸カリウムで中和し、生成した溶液を蒸発乾固する方法もあるが、塩化カリウム資源の豊富な所では、これを濃硝酸と反応させ、次の反応によって塩素とともに硝酸カリウムを製造している。
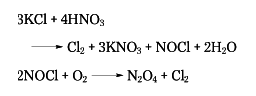
また、ブチルアルコール、アミルアルコール、エチルエーテルなどの有機溶媒中で反応させる工程も行われている。

常温では無色斜方晶系の結晶であるが、129℃で三方晶系に転移する。硝酸ナトリウムと異なり吸湿性はない。水に溶け、温度の上昇とともに溶解度は著しく増す。エタノール(エチルアルコール)にはわずかに溶けるが、エーテルには溶けない。融点以上に熱すると酸素を発生して分解する。
2KNO3 2KNO2+O2
2KNO2+O2
可燃性物質が共存すると爆発する。黒色火薬、マッチ、花火などの製造原料として用いられるほか、肥料、ガラス、うわぐすりなどの原料や、酸化剤、医薬品、さらに肉類の肉色固定剤などとしても使われる。
[鳥居泰男]
硝酸カリウム(データノート)
しょうさんかりうむでーたのーと
硝酸カリウム
KNO3
式量 101.1
融点 339℃
沸点 ―
比重 2.11(測定温度10.6℃)
屈折率 (n) 1.5038
溶解度 13.3g/100g(水0℃)
246g/100g(水100℃)
0.1g/100g(エタノール30℃)
改訂新版 世界大百科事典 「硝酸カリウム」の意味・わかりやすい解説
硝酸カリウム (しょうさんカリウム)
potassium nitrate
化学式KNO3。天然には硝石として乾燥地域の凝華物の形で少量産出する。無色の結晶。ふつうの結晶(α型)はアラレ(霰)石CaCO3型構造で,斜方晶系。129℃で硝酸カリウム型構造(三方晶系)のβ型(高温型)に転移する。β型を冷却すると,124℃で強導電体のγ型に変わり,110℃で再びα型にもどる。融点339℃。融点以上に熱すると,酸素を放って亜硝酸カリウムKNO2に変化する。
2KNO3─→2KNO2+O2
比重2.11(10.6℃)。屈折率1.5038。水100gへの溶解度は13.3g(0℃),31.59g(20℃),246g(100℃)。エチルアルコール100gに30℃で0.1g溶ける。硝酸ナトリウムと異なり,吸湿性がない。塩化カリウムの熱水溶液に硝酸ナトリウムを加え,複分解で生じた塩化ナトリウムの結晶を分離したのち,溶液を冷却すると硝酸カリウムが析出する。これを水溶液から再結晶で精製する。工業的にはもっぱら,炭酸カリウムまたは水酸化カリウムを,空中窒素固定で大量につくられる硝酸に溶解して製造する方法がとられる。黒色火薬,マッチ,花火などの火工品の製造,ガラス,うわぐすりの原料,酸化剤,ガラスの清澄剤,医薬(利尿・発汗・消炎薬),分析試薬などに用いられる。
執筆者:藤本 昌利
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「硝酸カリウム」の解説
硝酸カリウム
ショウサンカリウム
potassium nitrate
KNO3(101.10).天然には硝石として産出する.カリウムの炭酸塩または水酸化物に硝酸を作用させて濃縮すると得られる.無色の斜方晶系柱状晶.密度2.11 g cm-3.129 ℃ で三方晶系に転移する.融点339 ℃.400 ℃ 以上に強熱すると亜硝酸カリウムとなる.水に易溶,エタノールに微溶.硝石という名前で黒色火薬の主成分である.また,マッチや花火(赤紫色)の製造,焼入れ熱処理剤,ガラス,窯業,寒剤,食品添加物,医薬品,分析試薬,肥料などにも用いられる.[CAS 7757-79-1]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「硝酸カリウム」の意味・わかりやすい解説
硝酸カリウム【しょうさんカリウム】
→関連項目ダイナマイト
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「硝酸カリウム」の意味・わかりやすい解説
硝酸カリウム
しょうさんカリウム
potassium nitrate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「硝酸カリウム」の解説
硝酸カリウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

