精選版 日本国語大辞典 「カルノーサイクル」の意味・読み・例文・類語
カルノー‐サイクル
日本大百科全書(ニッポニカ) 「カルノーサイクル」の意味・わかりやすい解説
カルノー・サイクル
かるのーさいくる
Carnot's cycle
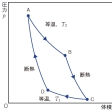
フランスのN・L・S・カルノーが考案した可逆サイクル。物体(あるいは物体系)が温度、圧力、体積などで決められる熱力学的な一つの状態から出発し、ある道筋を通ってふたたび初めの状態に戻る過程をサイクルという。サイクルには可逆サイクルと不可逆サイクルとがあるが、実際に行いうるサイクルはすべて不可逆サイクルである。カルノー・サイクルは次の四つの段階からなるサイクルである。(1)高熱源に接して、等温的に状態Aから状態Bへ移る。(2)断熱的に状態Bから状態Cへ移る。(3)低熱源に接して、等温的に状態Cから状態Dへ移る。(4)断熱的に状態Dから状態Aへ移る。ここで等温とは、作業体(サイクルを行う物体)の温度が一定に保たれることであり、断熱とは、作業体への外部からの熱量の出入りがないことである。
現実の動力機関では、摩擦や熱の伝導があって、完全な断熱変化や等温変化はありえない。したがって、実際には、カルノー・サイクルは成立しないが、変化がすべて可逆的に、すなわち摩擦や熱の伝導なしに行われるようなカルノー・サイクルは、サイクルの理想像としてきわめて大きな意味をもっている。カルノー・サイクルは、圧力pを縦軸に、体積Vを横軸にとったとき、のように、道筋A→B→C→D→Aで表される。A→Bでは高熱源から熱量Q2が吸収され、C→Dでは低熱源へ熱量Q1が放出される。熱力学第一法則により、この差
Q2-Q1=W>0
だけの仕事が外部へなされる。η=W/Q2は効率であるが、このようなカルノー・サイクルでは、η=(T2-T1)/T2であることが理論的に示される。ただし、T2、T1は、それぞれ高熱源および低熱源の絶対温度である。
[沢田正三]
改訂新版 世界大百科事典 「カルノーサイクル」の意味・わかりやすい解説
カルノーサイクル
Carnot's cycle
熱機関の効率を知るために,N.L.S.カルノーが考案した可逆サイクル。19世紀の初め,熱機関の急速な発達とともに,その効率を知ることが重要な問題としてとり上げられるようになった。これに関してカルノーは1824年の論文(ただしこの論文は20年後にケルビンによって認められるまで一般には知られていなかった)で,一般の熱機関の効率は,カルノーサイクルの熱効率より大きくなりえないことを示した。カルノーサイクルは,作業物質の,(1)等温膨張,(2)断熱膨張,(3)等温圧縮,(4)断熱圧縮の四つの過程を準静的,すなわち可逆的に行わせるもので,圧力pと体積vとの関係(p-v図)を示すと図のようになる。この可逆サイクルでは,等温膨張の間に高温(T1)の熱源から得た熱量Q1の一部Q2を,等温圧縮の間に低温(T2)の熱源に与えることによって動作している。Q1/Q2はT1/T2に等しく,また外に対してする仕事WとQ1との比,すなわち効率ηは,η=W/Q1=(Q1-Q2)/Q1=(T1-T2)/T1で与えられる。実際の熱機関の効率が,上の効率ηより大きくなりえないのは,熱力学の第2法則により,熱を仕事に変えるときに変化するエントロピーは,カルノーサイクルのような可逆過程に対して最小になり,とり出せる仕事が最大になるからである。
→エントロピー
執筆者:鈴木 増雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
ブリタニカ国際大百科事典 小項目事典 「カルノーサイクル」の意味・わかりやすい解説
カルノーサイクル
Carnot cycle
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「カルノーサイクル」の解説
カルノーサイクル
カルノーサイクル
Carnot's cycle
熱力学において,S. Carnot(1824年)が提唱した可逆サイクルのことで,図(a)に示すような準静的循環過程をいう.A→B(等温膨張),B→C(断熱膨張),C→D(等温圧縮),D→A(断熱圧縮).高温側の絶対温度 T1 における等温膨張で,作業物質が熱源から吸収する熱量を Q1,低温側 T2 における等温圧縮で,作業物質が熱源へ放出する熱量を Q2 とすると,作業物質が理想気体の場合,
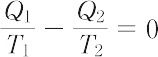
の関係が成立する.このサイクルによって熱量(Q1 - Q2)は仕事として外部に放出される.
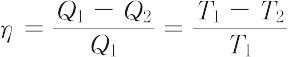
をこのサイクルの熱効率という.同じ熱源をもつ不可逆なサイクルの熱効率を ηirr とすると,η > ηirr の関係がつねに成立する.これをカルノーの定理とよぶ.
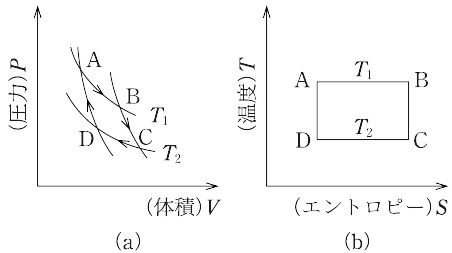
カルノーサイクルは熱力学第二法則の議論にしばしば利用される.縦軸に温度T,横軸にそれぞれの状態のエントロピーSを使うと,カルノーサイクルは図(b)のような長方形で表すことができる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「カルノーサイクル」の意味・わかりやすい解説
カルノーサイクル
→関連項目可逆機関|サイクル|絶対温度
出典 株式会社平凡社百科事典マイペディアについて 情報
法則の辞典 「カルノーサイクル」の解説
カルノーサイクル【Carnot's cycle】
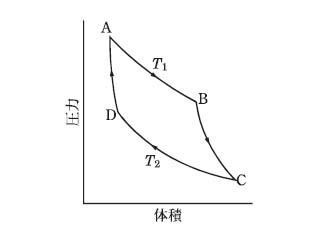

T1,T2 はそれぞれ高温熱源と低温熱源との熱力学的温度(絶対温度)である.
世界大百科事典(旧版)内のカルノーサイクルの言及
【クラペイロン】より
…のちに熱力学で用いられる物質の状態図の初めである。このほか,飽和水蒸気が凝結と蒸発を繰り返すカルノーサイクルを熱素説の立場から考察し,熱平衡にある物質の二つの相の圧力,体積,温度の関係を与えるクラペイロンの式(クラウジウス=クラペイロンの式)を導いた。【安孫子 誠也】。…
※「カルノーサイクル」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...