精選版 日本国語大辞典 「活性化エネルギー」の意味・読み・例文・類語
かっせいか‐エネルギークヮッセイクヮ‥【活性化エネルギー】
化学辞典 第2版 「活性化エネルギー」の解説
活性化エネルギー
カッセイカエネルギー
activation energy
化学反応で,原系から生成系に移る際,ポテンシャル障壁を越えるために必要な最小限のエネルギーをさす.活性錯体理論によれば,定容下の素反応速度定数 kc は,
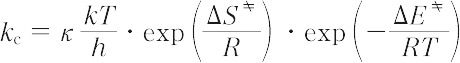
で表される.ここで,Δ E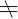 は活性化エネルギーであり,原系と活性錯体間の標準内部エネルギーの差に相当する.ただし,κは透過係数,kはボルツマン定数,hはプランク定数,Tは絶対温度,Rは気体定数,Δ S
は活性化エネルギーであり,原系と活性錯体間の標準内部エネルギーの差に相当する.ただし,κは透過係数,kはボルツマン定数,hはプランク定数,Tは絶対温度,Rは気体定数,Δ S は活性化エントロピーである.活性化エネルギーは,活性化熱Δ H
は活性化エントロピーである.活性化エネルギーは,活性化熱Δ H ,アレニウス式による見掛けの活性化エネルギーEa とは,活性化体積をΔ V
,アレニウス式による見掛けの活性化エネルギーEa とは,活性化体積をΔ V として,
として,
Δ E = Δ H
= Δ H - pΔ V
- pΔ V = Ea - RT
= Ea - RT
の関係がある.普通,
Δ E ,H
,H ,Ea≫pΔ V
,Ea≫pΔ V ,RT
,RT
であるため,実測にあたっては,厳密な測定や活性化エネルギーのきわめて小さい反応を除いては,この三者はしばしば混同して用いられ,単に活性化エネルギーといえば,アレニウス式による見掛けの活性化エネルギーをさす場合が多い.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「活性化エネルギー」の意味・わかりやすい解説
活性化エネルギー (かっせいかエネルギー)
activation energy
化学反応の進む過程をポテンシャルエネルギー図で表したとき,反応体分子が乗り越えなければならないポテンシャル障壁の高さを活性化エネルギーという。化学反応の始状態と終状態との間にあるポテンシャルエネルギーの山の部分を遷移状態と呼ぶが,遷移状態のエネルギーと始状態のエネルギーとの差がこれに相当する。反応が起こるためには反応体分子が活性化エネルギー以上のエネルギーをもつことが必要であり,そのような分子の衝突(活性化衝突)により反応が起こると考えられる。このとき速度定数の温度変化を表す〈アレニウスの式〉の中の定数の一つが活性化エネルギーに相当する。活性化エネルギーの概念は粘性,拡散などの輸送現象に対しても成り立つ。輸送現象に対する活性化エネルギーは1mol当り数kcal程度以下であるが,化学反応に対する活性化エネルギーは10~100kcalになる。
→反応速度
執筆者:妹尾 学
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「活性化エネルギー」の意味・わかりやすい解説
活性化エネルギー
かっせいかえねるぎー
activation energy
一つの化学反応が原系から生成系へ移るためには、途中に活性化状態(活性系。ここで活性錯合体が生成する)とよばれるもっともエネルギーの高い状態を経なければならないと考え、反応の原系から出発してこの活性系をつくるために必要なエネルギーを活性化エネルギーという。実験からこの活性化エネルギーの値を求めるのにはアレニウスの式を用いる。
k=Aexp(-Ea/RT)
この式は、反応速度定数kと反応温度T(絶対温度)との関係を与えるものであってEaが活性化エネルギーである。通常kの対数と温度の逆数との間の直線関係の勾配(こうばい)から活性化エネルギーEaが得られる(Aは定数で頻度因子とよばれ、Rは気体定数)。こうして求められた活性化エネルギーを見かけの活性化エネルギーという。いくつかの素反応(これ以上分けることのできない反応)からなる複合反応の場合、この見かけの活性化エネルギーは、素反応の活性化エネルギー(真の活性化エネルギー)に比べて、通常、内容が複雑になる。化学反応以外の、拡散などの輸送現象、その他の物理的変化にも同じような考え方が適用され、活性化エネルギーが求められる。
[戸田源治郎・中原勝儼]
最新 地学事典 「活性化エネルギー」の解説
かっせいかエネルギー
活性化エネルギー
activation energy
化学反応が起こる際には,反応物質がポテンシャルエネルギー障壁の頂点にある活性複合体(acti-vated complex)を越え,生成物質に至る。活性複合体と反応物質との間の標準ギブス自由エネルギーの差ΔG°,あるいは標準ヘルムホルツ自由エネルギーの差ΔA°を活性化エネルギーという。活性化エネルギーをΔG°とすると,ある反応の速度定数kの温度依存性はk=κ(kBT/h)exp(-ΔG°/RT)で表される。ここで,κは透過係数,kBはボルツマン定数,hはプランク定数,Rは気体定数,Tは絶対温度である。触媒の存在は主としてΔG°を低下させ,その結果として反応速度を増大させる。
執筆者:吉田 尚弘
出典 平凡社「最新 地学事典」最新 地学事典について 情報
百科事典マイペディア 「活性化エネルギー」の意味・わかりやすい解説
活性化エネルギー【かっせいかエネルギー】
→関連項目アイリング|活性錯合体
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「活性化エネルギー」の意味・わかりやすい解説
活性化エネルギー
かっせいかエネルギー
activation energy
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「活性化エネルギー」の解説
活性化エネルギー
世界大百科事典(旧版)内の活性化エネルギーの言及
【アレニウスの式】より
…化学反応の速度は一般に温度によってかなり大きく変化し,速度定数kと絶対温度Tとの間に近似的に次の関係式が成り立つ。 k=A exp(-Ea/RT)ここでRは気体定数,AおよびEaは反応に固有の定数で,Aは頻度因子,Eaは活性化エネルギーと呼ばれる。この関係は1889年スウェーデンのS.A.アレニウスにより提出されたもので,アレニウスの式と呼ばれる。…
【反応速度】より
…アレニウスは,この結果を,反応はある一定値以上のエネルギーをもつ分子によってひき起こされ,そのような分子の数は温度が高くなるとともに増大するためと考えた。すなわち,反応が起こるためにはある大きさ以上のエネルギーが必要であり,これを活性化エネルギーと呼ぶ。式(5)のEaが活性化エネルギーに相当する。…
※「活性化エネルギー」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...


