翻訳|distillation
精選版 日本国語大辞典 「蒸留」の意味・読み・例文・類語
じょう‐りゅう‥リウ【蒸留・蒸溜・蒸餾】
- 〘 名詞 〙
- ① 溶液を蒸発させて、その蒸気を再び凝縮して集めることにより、溶液の成分を分離すること。ウイスキー、焼酎(しょうちゅう)などはこの方法で作られる。
- [初出の実例]「其受器の水四十八
 に至るを度とし蒸餾を歇む」(出典:舎密開宗(1837‐47)内)
に至るを度とし蒸餾を歇む」(出典:舎密開宗(1837‐47)内)
- [初出の実例]「其受器の水四十八
- ② 物事の精髄だけをとり出すこと。物や事柄の不純な部分や付属物を除くこと。
- [初出の実例]「此種類の人物は十人を蒸溜して、智徳の量、一斗を得たるに」(出典:文明論之概略(1875)〈福沢諭吉〉二)
蒸留の語誌
( 1 )「蒸留」の「留」は、「餾」あるいは「溜」が当用漢字(常用漢字)にないための代用字。中国、明の宋濂の詩に「今年度庾嶺、熱気甚蒸餾」とあり、外気の状態について「むす」の意味で用いられている。この語が蘭学の翻訳の必要から化学的操作の意味で用いられるようになったものと思われる。
( 2 )明治期では「医語類聚」(一八七二)「薬品名彙」(一八七三)「工学字彙」(一八八六)などは「餾」を、挙例の「文明論之概略」や「和英語林集成(再版)」は「溜」を用いており、両様の表記があった。
日本大百科全書(ニッポニカ) 「蒸留」の意味・わかりやすい解説
蒸留
じょうりゅう
distillation
一般にある溶液(混合溶液)を加熱し、その一部を揮発させ、発生した蒸気を別の場所に移して凝縮させる操作をいう。正確にはこれだけでは単蒸留という。以前は「蒸溜」という字を用いたが、「留」では逆の意味になってしまった。
[山崎 昶]
歴史
混合溶液を蒸留すると、通常は組成の異なる2種以上の液体に分けることができる。古くより発酵酒からアルコール分を濃縮するのに用いられてきた。この起源は古代ギリシア時代にまでさかのぼりうるという。当時の陶製の蒸留容器はアムビックスambixとよばれたが、やがてイスラム文化圏に伝わり、のち、スペインを経てヨーロッパ各国に再輸入された。英語のアランビックalembicはこのような歴史を示している。日本にも江戸時代に輸入され、国内でも意匠を凝らしたものができて「蘭曳(らんびき)」とよばれた。当時の豪商は、客の面前で自ら蘭曳から蒸留した酒を客に供するのを最高のもてなしとしたので、いろいろと風雅な高級品がつくられた。このように蒸留は古くから用いられた分離・精製の手段で、現在では化学工業において、きわめて重要な手法の一つとなっている。
蒸留の装置には、少なくとも罐(かま)、凝縮器、受器の3部分が必要である。罐は原料液を入れて加熱するところ、凝縮器は発生した蒸気から熱を奪って液化を行うところ、受器は凝縮した液体をためるところである。
[山崎 昶]
蒸留の基本原理
たとえば、混合溶液が低沸点成分Aと高沸点成分Bとからなる二成分系を考えてみよう。混合溶液をフラスコに入れて加熱し、出てくる蒸気を凝縮器で凝縮させると、その成分は、初めの混合溶液よりも低沸点(したがって揮発性に富んだ液)であるのが普通である。そして、フラスコ内に残った液は高沸点の揮発しにくい成分が多くなっている。このようにA、Bの揮発度の差を利用して、蒸発・凝縮を組み合わせて、混合溶液を揮発しやすい部分と、揮発しにくい部分とに分けることができる。凝縮して得られた液体を留分(溜分)、蒸発せずに残ったほうを罐残(かまざん)という。
[山崎 昶]
分縮
混合蒸気が一部分凝縮をおこすと、生じた液相と残存の気相の組成は通常は等しくない。液相はもとの混合蒸気よりも高沸点成分が、気相は低沸点成分が多くなる。このように一部分を凝縮させて、低沸点成分の相対濃度を増加させる操作のことを分縮という。分縮で生じた液相がふたたび新しい蒸気と接触するようにして行う蒸留を「精留」という。
[山崎 昶]
いろいろな蒸留法
前述のような簡単な装置の組合せでできる「単蒸留」のほかにもいろいろな蒸留法がある。「分別蒸留」「減圧蒸留」「水蒸気蒸留」「分解蒸留」「抽出蒸留」「平衡蒸留」「共沸蒸留」「精密蒸留」「非沸騰蒸留」「分子蒸留」などと~蒸留の名でよばれるものは数多い。このうち初めの7項目については、それぞれのところに詳しい記載があるから、ここでは簡略な紹介にとどめることにする。
[山崎 昶]
減圧蒸留
よく「真空蒸留」などといわれるが、せいぜい数トルから数十トル(1トルはほぼ水銀柱1ミリメートルの圧力)ぐらいで行う蒸留なので、やはり「減圧蒸留」のほうがふさわしい。水流ポンプなどを利用して実験室ではよく行われる方法であるが、工業的には装置が大規模となることもあってあまり用いられない。
[山崎 昶]
水蒸気蒸留
水とまったく混合しない成分と水との混合系と平衡にある蒸気圧は、両方の純成分の蒸気圧の和となる。この和が大気圧と等しくなれば沸騰がおこる。たとえば水とテレビン油の混合物に加熱水蒸気を吹き込むと、前記の条件によって両成分の混合物が気化するから、凝縮させて分離を行う。沸点が高くて加熱すると分解するものでも、比較的低温で精製できる。
[山崎 昶]
分解蒸留
石油のクラッキングの生成物はそれ自体がかなり高温であるから、ただちに精留塔に導いて蒸留操作を行う。その操作をまとめて分解蒸留という。装置もクラッキング装置と精留塔とをまとめて分解蒸留装置という。
[山崎 昶]
抽出蒸留
沸点の接近した成分の混合物に用いられる蒸留法。後述の共沸蒸留とは違って、揮発性の小さい第三の成分を添加し、一方の蒸気圧を大きく下げて分離を可能とさせる。
[山崎 昶]
平衡蒸留
フラッシュ蒸留といわれるほうが多い。これは成分の分離をかならずしも目的とせず、溶液を蒸気と液体に急速に分離する方法である。高温に加熱した液体の一部を蒸気とともに採取し減圧すると、溶液は自身の蒸気と平衡を保ちつつ急速に蒸発する。石油工業でのパイプスチルのほか、海水の脱塩や廃液の処理などにも用いられている。
[山崎 昶]
共沸蒸留
通常の蒸留では分離が困難な混合物を分離するのに、第三の成分を添加して共沸混合物をつくらせ、蒸留によって分離を行う方法。96%エタノールにベンゼンを加えて蒸留脱水を行うなどが好例である。抽出蒸留と比較されたい。
[山崎 昶]
精密蒸留
多段の精留塔を用い、わずかな沸点の差を利用して混合物中の成分を分離する方法をいう。
[山崎 昶]
非沸騰蒸留
蒸留は精製を目的として行われるが、蒸留の効率から考えると、罐の内容物を沸騰させて蒸気を大量に生成するような条件で行うのが通常である。だが、不純物の混入を押さえるためには、効率はさほど高くなくともよい場合もある。沸点以下でもかなり高い蒸気圧をもつ物質であれば、蒸気を凝縮させることによって、精製度を向上させることができる。これを非沸騰蒸留あるいは亜沸点蒸留とよぶ。
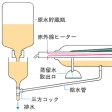
通常の沸点まで加熱するタイプの蒸留装置(沸騰型)で蒸留水をつくることを考えると、(1)容器の内面のぬれによる原水の這(は)い上がり(クリーピング)、(2)蒸留時のミスト生成による原水の流出液への混入、(3)残液の不純物濃度の上昇、の3原因のために、蒸留によっても、ある程度以上のきれいな水を得ることはできない。とくに(2)のミストの混入は重要な汚染源である。このミストの生成は、沸騰によって液相の内部から気体(蒸気)が発生するときに、液体の飛散が伴うことが原因である。そこで赤外線加熱などにより、沸騰させぬように表面から緩やかに蒸発をおこさせ、この蒸気を凝縮させると、ミストによる汚染が除かれるから純度の高い留出液が得られる。原子吸光などの高感度の分析法に用いる水や試薬の調製によく用いられる手法である。
[山崎 昶]
分子蒸留
普通の減圧蒸留法では蒸留できない高沸点のものにも応用できるように考案された蒸留法。圧力を10~100マイクロトルとして加熱する。液面と冷却面との間隔を分子の平均自由行程(相次ぐ衝突間に飛翔(ひしょう)しうる距離の平均)よりも小さくすると、液面から逸散した分子はほとんど冷却面に補修され、液化、凝縮がおこる。平均自由行程は分子量と圧力の関数であるので、圧力と間隔を調整することによって他の成分との分離が可能となる。その昔は同位体分離に応用されたこともあるが、なかなか気化しにくい高分子物質の蒸留精製や、高温では分解しやすい脂溶性ビタミン類の蒸留などに用いられている。
[山崎 昶]
『化学工学協会編『化学工学の進歩17 蒸留技術』(1983・槇書店)』
改訂新版 世界大百科事典 「蒸留」の意味・わかりやすい解説
蒸留 (じょうりゅう)
distillation
液体混合物を,その成分の熱的性質(沸点とか蒸気圧など)の差を利用して分離する操作。現在工業的に最も多く用いられている分離操作である。空気のように通常は気体の混合物でも,-200℃近くまで冷却して液化すれば,蒸留によって,その成分すなわち酸素,窒素,アルゴンに分離することができる。またエチレンとかプロピレンのような気体も,加圧することにより液化し,蒸留による精製を行っている。また,通常は固体であるものも,加熱して液化させれば蒸留によって分離することができる。
蒸留の原理
たとえば,メチルアルコール50%を含む水溶液100gを図のaのようなフラスコに入れて加熱すると,約70℃で沸騰して蒸気が出てくる。これをコンデンサー(凝縮器)で凝縮してメスシリンダーにため,フラスコの液が半分くらいになったところで加熱を止めて,メスシリンダー中の液を分析すると約70%のメチルアルコールが含まれていることがわかる。すなわち,メチルアルコール(沸点64.65℃)のほうが水(沸点100℃)よりも蒸発しやすいわけである。これがもともとの蒸留の原理である。このような方法を繰り返せば,純粋に近いメチルアルコールを得ることはできるが,その量はおそらく1g程度しか得られないであろう。
そこで,次にくふうされたのが図のbのような回分蒸留塔である。下方のフラスコまたは缶にやはり100gの水溶液を入れて加熱し,塔頂から出てきた蒸気を凝縮させて,それを再び塔頂に戻す(還流)と,その液は温度が低いので,下から上ってくる蒸気と接触すると蒸気の一部を凝縮させる。その際重い成分(この場合は水)をより多く凝縮させるので,蒸気の凝縮しない部分は軽い成分(この場合メチルアルコール)に富むことになり,このような繰返しによって塔頂にメチルアルコールが集まってくる。塔頂で温度を測定し,その温度がメチルアルコールの沸点64.65℃に近くなったら,塔頂から留出液を取り出すと,純粋に近いメチルアルコールが得られることになる。しかし,そのときでも塔頂の液の一部は塔へ還流液として戻さなければならず,留出させる液量Dに対する塔への還流液量Lの比L/Dを還流比と呼んでいる。ある程度留出させると留出液中に水も混ざってくるので蒸留を中止する。このようにすると,純粋に近いメチルアルコールはおそらく20gくらいは得られるであろう。しかし残りの30gは塔内に残ってしまう。
最後に考えられた方法が図のcのような現在工業的に用いられている連続蒸留塔である。蒸留塔の中間部に連続的に原料を供給して,塔頂と塔底とからそれぞれ純粋に近いメチルアルコールと水とを抜き出す方法で,最も理想的な方法である。塔頂ではもちろん還流を行い,塔底にはリボイラーと呼ばれる加熱蒸発装置をつけるのである。蒸留塔の大きさや還流比などは原料混合液の性質に基づいて計算され,決定されるようになっている。
なお,還流を行いながら蒸留を繰り返す分離操作を特に精留rectificationと呼ぶが,工業的には蒸留といえばほとんどの場合精留を意味する。また,適当な温度間隔をもって2種以上の成分の留出液を分け取る蒸留法を分留fractional distillationという。
蒸留装置
上述のように蒸留方法には回分蒸留と連続蒸留とがあり,工業的には後者が主として用いられ,前者は実験室で主として用いられている。しかし比較的量の少ない混合物の処理には回分蒸留が工業的に用いられることもある。
蒸留塔の内部構造としては気-液が接触しやすくした棚段塔と充てん(塡)塔とが主として用いられる。材質としては実験室用にはガラスが用いられ,工業的には主としてステンレス鋼が用いられるが,特別に腐食性の強い物質を取り扱う場合には,その他の材質たとえばガラスが用いられる。
操作圧力としては高圧蒸留(普通は数十気圧まで),常圧蒸留および減圧蒸留があり,減圧蒸留はさらに200mmHg程度までの減圧蒸留,1mmHg程度までの真空蒸留と10⁻1mmHg以下の分子蒸留とに分けられる。
→真空蒸留 →分子蒸留
特殊な蒸留
石油は非常に多数の成分からなる混合物であるが,まずはじめに常圧蒸留塔に供給し,塔頂からはガスを,塔底からは重質残渣油を取り出し,塔の中間では上のほうから順にナフサ,灯油,軽油などを抜き出して製品を得ている。このように塔の中間から留出液を抜き出すことは他の蒸留でも行われることがあり,これらの中間抜出し留出液のことをサイドカットside cutまたは側流という。
蒸留塔への原料の供給は1ヵ所とは限らず,2ヵ所以上へ供給することもある。特別な例としては,蒸留塔の上の部分へ酢酸を,下の部分へエチルアルコールを供給して,塔の中央部分でエステル化反応と蒸留を同時に行わせて,塔頂から酢酸エチルを含む留出液を,塔底から水を取り出す方法が行われており,反応蒸留と呼ばれている。
ある種の混合物のある組成においては,液の組成とそれに平衡な蒸気の組成が等しくなることがあり,これを共沸混合物と呼んでいる。このような場合には普通の蒸留では純粋な成分に分離することができないので,抽出蒸留とか共沸蒸留によって分離を行っている。また,水に溶解しにくい物質の精製には,液の中に直接水蒸気を吹き込んで蒸留を行うことがある。このような蒸留を水蒸気蒸留と呼んでいる。
→共沸蒸留 →水蒸気蒸留 →抽出蒸留
執筆者:平田 光穂
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「蒸留」の意味・わかりやすい解説
蒸留【じょうりゅう】
→関連項目蒸留水
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「蒸留」の解説
蒸留
ジョウリュウ
distillation
多成分の混合溶液を加熱すると,発生した蒸気の組成は溶液とは異なり,揮発しやすい成分が多く含まれる.これを利用して,液体混合物を各成分ごとに分離する操作を蒸留といい,化学工業で広く利用されている重要な分離操作の一つである.操作圧は1 atm 程度の常圧蒸留が普通であるが,数 atm 以上を高圧蒸留,1 atm 以下を減圧蒸留,数百 Pa 以下を真空蒸留,10-1 Pa 以下を分子蒸留と区別している.ウイスキー,ブランデーなどは回分操作で蒸留されているが(単蒸留),石油精製工場では,大規模な連続操業が行われている.なお,普通の蒸留法では,成分の分離が困難な場合には,さらに第三の物質を添加する共沸蒸留,水蒸気蒸留,あるいは抽出蒸留などの方法が用いられる.[別用語参照]精留
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「蒸留」の意味・わかりやすい解説
蒸留
じょうりゅう
distillation
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「蒸留」の解説
蒸留
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...