翻訳|aniline
精選版 日本国語大辞典 「アニリン」の意味・読み・例文・類語
アニリン
- 〘 名詞 〙 ( [英語] aniline [ドイツ語] Anilin ) ベンゼンから誘導されるアミンの一つ。特有の臭気をもつ無色透明の液体。空気中で酸化され徐々に黄色を帯びる。毒性があり、吸入、皮膚吸収などで中毒症状を起こす。合成染料の原料。アミノベンゼン。フェニルアミン。
- [初出の実例]「瓦斯は勿論〈略〉アニリンを製出する利益あり」(出典:東京日日新聞‐明治一八年(1885)一〇月二七日)
日本大百科全書(ニッポニカ) 「アニリン」の意味・わかりやすい解説
アニリン
あにりん
aniline
代表的な芳香族アミン。アミノベンゼン、フェニルアミンともいう。特有のにおいをもつ無色の液体。ベンゼンと並んで有機化学および化学工業上もっとも重要なものとされる。
[山本 学]
歴史
1826年ドイツのウンフェルドルベンOtto Unverdorben(1806―1873)によって初めてインジゴの乾留生成物からみいだされ、1840年フリッチェC. J. Fritzscheにより構造が確定され、スペイン語のanil(インジゴの意味)にちなんでアニリンの名が与えられた。1856年イギリスのパーキンは不純なアニリンの酸化により紫色の色素モーブを得たが、これが最初の合成染料であり、近代化学工業の発展の端緒となった。
[山本 学]
製造法
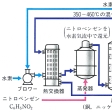
ニトロベンゼンをスズまたは鉄と塩酸で還元するか、銅、ニッケルなどの金属触媒を用いて水素添加する還元法が一般的であるが、クロロベンゼンを高温高圧下にアンモニアと反応させる方法(アンモノリシス)もある。
[山本 学]
性質
水にわずかに溶け、エタノール(エチルアルコール)、エーテル、ベンゼンなどに溶けやすい。水蒸気蒸留できる。クロロホルムなどに溶かして臭素を加えると2,4,6-トリブロモアニリンの白色沈殿を生成する。クロロホルムおよび水酸化アルカリと加熱するとイソニトリルを生成し悪臭を放つ(カルビルアミン反応)。さらし粉溶液を加えると紫色を呈する。これらの反応はアニリンの定性試験に用いられる。弱塩基であり、酢酸、塩酸、硫酸などと塩をつくる。アルカリ金属、アルカリ土類金属と反応し、水素を発生して金属塩をつくる。無機酸とともに亜硝酸を作用させてジアゾニウム塩を生成する反応(ジアゾ反応)は、これから種々の芳香族化合物に誘導することができ、工業的にも重要である。
[山本 学]
保存上の注意
空気中に置くと徐々に赤く着色したり、光によって変質するので、密栓をして暗所に蓄える必要がある。有毒なので吸収しないよう取扱いには注意しなければならない。
[山本 学]
用途
現在では染料の原料のみならず、香料、医薬品の合成の原料や溶媒、アニリンアルデヒド樹脂の原料にもなるなど、有機合成化学工業において用途は大きい。
[山本 学]
『『アミンケミカルスの市場』(1995・シーエムシー、ジスク発売)』▽『大木道則著『入門 有機化学』(2001・朝倉書店)』
アニリン(データノート)
あにりんでーたのーと
アニリン
分子式 C6H7N
分子量 93.13
融点 -6℃
沸点 184℃
比重 1.022(測定温度20℃)
溶解度 3.6g/100ml(水18℃)
屈折率 (n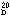 )1.5863
)1.5863
引火点 76℃
改訂新版 世界大百科事典 「アニリン」の意味・わかりやすい解説
アニリン
aniline
代表的な芳香族アミンで,アミノベンゼン,フェニルアミンともいう。1826年ウンフェルドルベンO.Unverdorbenはインジゴの分解生成物の一つをクリスタリンcrystallinと命名し,34年ルンゲF.F.Rungeはコールタールから得られる油状物質がさらし粉溶液によって鮮やかな青色を示すのを観察し,ギリシア語のkyanos(青色)とラテン語のoleum(油)からキュアノールkyanolと呼んだ。フリッチェC.J.Fritzscheはインジゴをアルカリで加熱分解し,蒸留で得られた油状物質をアニリンと命名し,構造を提案した。インド産植物のインジゴをサンスクリット語でnīlāといい,アラビア人は定冠詞をつけてal nilと呼んでいた。スペイン人はさらに変更してanilといっていたので,フリッチェはこの物質にアニリンの名をつけた。一方,1842年ツィニンN.N.Zininはニトロベンゼンを硫化アンモニウムで還元して得られる油状物質をベンジダムbenzidamと命名した。A.W.vonホフマンもニトロベンゼンを水素で還元して得られる塩基性油状物質の構造を確認(1843),これがベンジダム,アニリンと同一物質であることを明らかにした。
性質
特異の臭気をもつ無色の液体で,融点-5.98℃,沸点184.55℃,比重1.022(20℃)。酸化されやすく,光または空気の作用でしだいに黄色から褐色,ついにはほとんど黒色となるが,亜鉛を加えて蒸留すると無色に精製される。水にはわずかしか溶けないが,ベンゼン,エチルアルコール,エーテルなどにはよく溶ける。塩基解離指数pKb=9.404(25℃)の弱い塩基で,塩酸,硫酸,酢酸などと反応して水に溶けやすい結晶性の塩をつくる。同じ第一アミンに属するメチルアミンCH3NH2はpKb=3.32(25℃)で,アニリンはこれに比べるとかなり塩基性が弱い。これは,芳香族アミンでは窒素原子上の非共有電子対がベンゼン環に非局在化するためである。これを下の図に示すような共鳴による安定化で説明することもできる。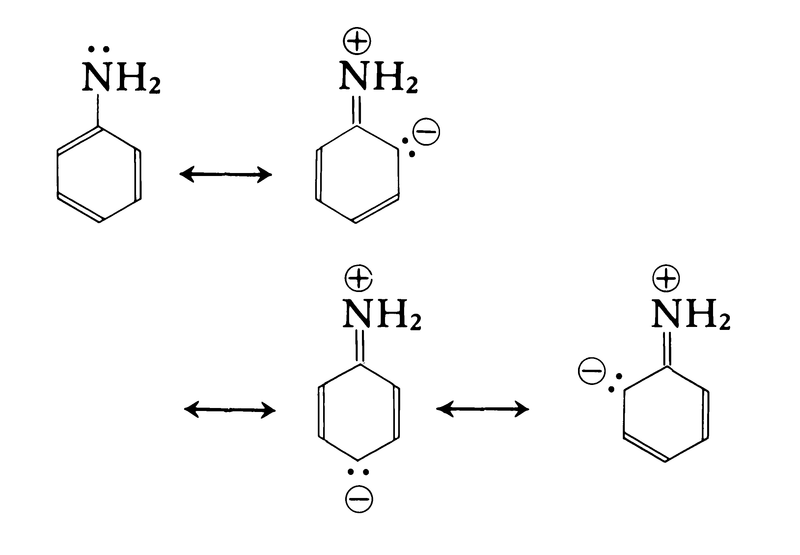
したがって,電子求引性の置換基によって塩基性は低下する。ニトロ基で置換したp-ニトロアニリンはpKb=13.009(25℃)である。アニリンを含む水にさらし粉の水溶液を加えると赤紫色を呈する。この呈色反応はきわめて鋭敏なので,アニリンの検出に用いられる。アニリンの塩酸酸性水溶液を氷冷しながら亜硝酸ナトリウムを加えるとジアゾ化が起こり,塩化ベンゼンジアゾニウムを生じる。
これはフェノール,アニリンなどと反応してアゾ化合物をつくるが,この反応でアゾ染料など多くの化合物が合成される。アニリンはカルボン酸またはその無水物と反応して一種のアミドであるアニリドを生じる。アニリンは有毒で,吸入すると中枢神経がおかされ,めまい,頭痛などを起こすが,重症のものでは黄疸,けいれん,昏睡状態になり,慢性中毒では全身衰弱になる。皮膚にふれると炎症を起こす。
製法
工業的にはニトロベンゼンを水素で接触還元するか,亜鉛(またはスズ,鉄)と塩酸で還元してつくる。また,クロロベンゼンを液体アンモニアでアミノ化したり,フェノールにアンモニアを加えて分解しても得られる。実験室ではニトロベンゼンの水素による還元の方法が用いられるが,硫化水素または硫化ナトリウムで還元することもある。
利用
アニリンはベンゼンとともに有機化学および合成化学工業上,大きな役割を果たしている。とくに染料合成は,1856年イギリスのW.H.パーキンが不純なアニリンを重クロム酸塩と硫酸で酸化して紫色の色素モーブを得たことに始まる。ついでナタンソンJ.Natansonもアニリンからマゼンタ(フクシン)を合成し,当時の合成染料はアニリンを原料とするところからアニリン染料と呼ばれていた。アニリンはほかに樹脂,医薬品,香料の製造原料や溶媒などに用いる。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「アニリン」の解説
アニリン
アニリン
aniline
phenylamine,benzenamine.C6H7N(93.13).C6H5NH2.ニトロベンゼンの還元(鉄と塩酸,あるいはニッケルや銅を触媒とする接触還元など),またはクロロベンゼンのアンモノリシスによって製造される代表的な芳香族第一級アミン.液体.凝固点-6 ℃,沸点184 ℃,92 ℃(4.4 kPa),71 ℃(1.2 kPa).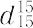 1.0268.
1.0268.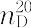 1.5863.蒸留精製したものは無色透明であるが,空気中で徐々に酸化され,黄ないし赤味を帯び,ついには黒色不透明となる.水に微溶(3.4 mL/水100 mL,20 ℃),エーテル,エタノール,ベンゼンなどの有機溶剤に易溶.弱塩基性を示し(pKa 4.60),結晶性の塩酸塩,硫酸塩などをつくる.人体に対し毒性があり,蒸気を吸入したり,皮膚から吸収したりすると中毒を起こす.染料,ゴム薬品,医薬品,合成樹脂などの原料として用いられる.LD50 440 mg/kg(ラット,経口).[CAS 62-53-3]
1.5863.蒸留精製したものは無色透明であるが,空気中で徐々に酸化され,黄ないし赤味を帯び,ついには黒色不透明となる.水に微溶(3.4 mL/水100 mL,20 ℃),エーテル,エタノール,ベンゼンなどの有機溶剤に易溶.弱塩基性を示し(pKa 4.60),結晶性の塩酸塩,硫酸塩などをつくる.人体に対し毒性があり,蒸気を吸入したり,皮膚から吸収したりすると中毒を起こす.染料,ゴム薬品,医薬品,合成樹脂などの原料として用いられる.LD50 440 mg/kg(ラット,経口).[CAS 62-53-3]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「アニリン」の意味・わかりやすい解説
アニリン
→関連項目アニリン染料|アミン|塩基性染料|工業中毒|染料|モーブ
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「アニリン」の意味・わかりやすい解説
アニリン
aniline
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内のアニリンの言及
【石炭化学工業】より
…71年には大阪造幣局で石炭ガスがつくられ,72年には横浜にガス工場ができてガス灯が使われた。 このように石炭乾留によるガスやコークスの生産が活発になってきたため,副産物として生ずるコールタールを化学的に利用する研究も進められ,1845年ドイツのA.W.vonホフマンがコールタールの中にベンゼンを発見し,さらに56年イギリスのW.H.パーキンがベンゼンから得られたアニリンを原料に染料を合成することに成功し,コールタールが合成染料の原料として注目された。 日本では,1901年東京瓦斯(ガス)がコールタールを蒸留して初めてベンゼンを工業的に生産した。…
※「アニリン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...