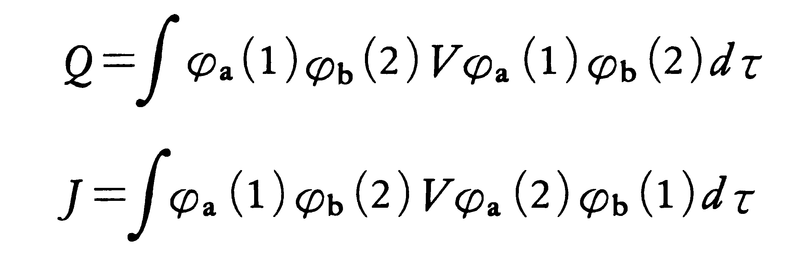ハイトラー-ロンドンの理論
ハイトラーロンドンノリロン
Heitler-London's theory
W. HeitlerとF. London(ロンドン)によって,1927年に提出された水素分子の共有結合に関する理論.この理論によれば,水素原子A,Bの各1s軌道関数φA,φB に,それぞれ電子1,2が属している状態Ⅰの波動関数ψⅠは,
φA(1)φB(2)
で表されるが,この状態Iは原子間で二つの電子を交換した状態Ⅱ,すなわち,
ψⅡ = φA(2)φB(1)
とは区別できないはずである.したがって,全体の波動関数Φは,これらの一次結合によって表されると考える.すなわち,
Φ± = (ψⅠ± ψⅡ)/ ,
,
水素分子のエネルギーWは
W = Q±J
となる.ただし,φA と φB は直交しているものとし,QとJはそれぞれクーロン積分および交換積分である.Jは量子力学ではじめて現れた量で負の値をとる.Φ+ で表される状態では核間距離がある値のとき最小となり,安定な分子の形成を示す.このことより,結合の本質は電子の交換力にあるということができる.なお,パウリの(排他)原理によれば,軌道関数およびスピン関数も含めた電子系の全波動関数は,電子の交換によってその符号をかえなければならない(反対称).上記の波動関数 Φ± のうち,Φ- は電子の交換によって符号をかえるが,Φ+ は符号をかえない.したがって,Φ- および Φ+ と組み合わされるスピン波動関数は,それぞれ対称および反対称でなければならない.すなわち,安定な結合(Φ+)をつくるとき,一対の電子のスピンは反平行でなければならないことが結論される.このように,ハイトラー-ロンドンの理論は,共有結合の本質をはじめて明らかにしたという点で,歴史的に重要であり,原子軌道関数法の発展の基礎となった.すなわち,この理論はJ.C. SlaterおよびL. Pauling(ポーリング)によって多原子分子に拡張され,方向原子価の問題をはじめとして,原子価の諸概念やそれらの機構の説明に重要な役割を果たした.[別用語参照]原子価結合法,スレーター-ポーリング法
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
ハイトラー‐ロンドンの理論
はいとらーろんどんのりろん
Heitler-London's theory
水素分子の共有結合生成について、1927年、理論物理学者のW・H・ハイトラーとF・ロンドンが、量子力学的な取扱いをして説明した理論。この理論によって初めて共有結合生成の機構が理論的に明らかにされ、その後の各種多原子分子についての原子価理論の発展の基礎となった。
水素分子の二つの水素原子をHA、HBとし、それぞれの1s軌道をχA、χB、さらに2個の電子にそれぞれ1、2と番号づけをする。このときHA、HB水素原子にそれぞれ電子1、2が所属するときの状態ⅠをχA(1)・χB(2)と表し、二つの水素原子それぞれに、2、1が所属するときの状態ⅡをχA(2)・χB(1)で表す。このようにしたとき、電子1、2が二つの水素原子HA、HBに共有されているという状態を、ⅠとⅡが重なったものとして、Ψ=N{χA(1)・χB(2)±χA(2)・χB(1)}(Nは規格化定数)で表されると考える。このような波動関数Ψを用い、二つの水素原子HA、HBが結合していないときを基準にして計算すると、水素分子のエネルギーWは、W=Q+Jで表される。Qはクーロン積分といわれるもので、二つの原子核と二つの電子からなる系のクーロン力による静電エネルギーである。Jは交換積分とよばれるもので、二つの電子の交換によって生ずる安定化エネルギーである。このときJの値は負で、絶対値がQより大きく、共有結合を支配する要素になっているが、これは古典的な理論にはない結合力であるといえる。このような電子の交換によって原子間の共有結合が初めて説明されたことは、この理論を出発点としてその後の量子化学的原子価理論が発展したことからいって、きわめて意義のあるものといえる。
[中原勝儼]
『日本化学会・小島穎男・東健一編『化学の原典1 化学結合論1――原子価結合法』(1975・学会出版センター)』▽『ジャック・バレット著、吉沢一成訳『化学結合の基礎』(2004・化学同人)』
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
ハイトラー=ロンドンの理論 (ハイトラーロンドンのりろん)
Heitler-London's theory
水素分子における化学結合の量子力学的な説明として,W.ハイトラーとF.ロンドンが1927年に提出した理論。この理論によって初めて水素分子の化学結合の本質が明らかにされた。これが,多原子分子についての原子価結合法と呼ばれる量子化学的方法の基礎となっている。水素分子の2個の水素原子にa,bと符号をつけ,それぞれの1s軌道をφa,φbと表し,さらに2個の電子に1,2と符号をつけて区別するとき,水素分子の波動関数がφa(1)・φb(2)とφa(2)・φb(1)の二つの波動関数の1次結合
Ψ±=N{φa(1)・φb(2)
±φa(2)・φb(1)}
で表されると考える。ここでNは規格化定数である。このような近似的な波動関数を採用すると,原子間の結合力はほぼQ±Jとなる。ただし,原子間の相互作用を与えるポテンシャル関数をVとするとき,
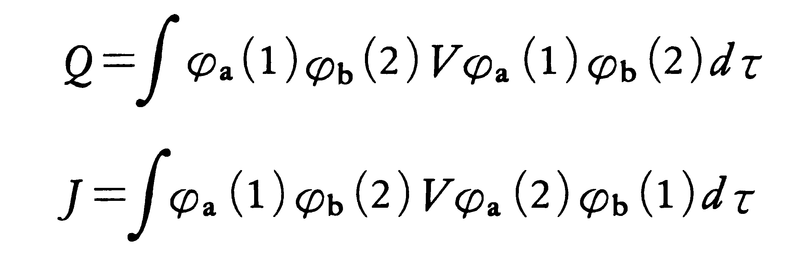
であり,前者がクーロン積分,後者が交換積分である。Jは負で,その絶対値がQより大きい。したがってΨ+のほうが水素分子の基底状態に相当し,結合力の大きさが交換積分Jで支配されることになる。これは古典的な理論にはない結合力である。波動関係がΨ+のように表現されることは,二つの原子a,bの間で電子の交換が行われていることを意味するが,そのような効果交換力によって原子間の化学結合が生じていることが,この理論によって初めて明らかにされた。
執筆者:黒田 晴雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
ハイトラー=ロンドンの理論
ハイトラー=ロンドンのりろん
Heitler-London's theory
水素分子の結合エネルギーを説明するために,1927年 W.ハイトラーと F.ロンドンが考案した計算法。水素分子中の2個の電子は,互いにその位置を交換すると考える。このために2つの電子のスピンが逆向きのときは,孤立原子に比べてエネルギーが低くなり,水素分子の結合エネルギーが得られる。すなわち2個の水素原子が原子として存在するよりも化学結合して1個の水素分子として存在するほうが安定な理由は,主として原子核付近の2個の電子が互いに位置を交換することによって生じる安定化エネルギー (交換エネルギー) によるとしている。この理論は水素分子に限らず他の共有結合にも広く適用される。これは化学結合を量子力学的に取扱った最初の理論で,いろいろな分子の結合力に対して分子軌道法とともによく用いられる。磁性体における交換相互作用は,この理論が基礎になっている。 (→原子価結合法 )
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
 ,
,