翻訳|calcium
精選版 日本国語大辞典 「カルシウム」の意味・読み・例文・類語
カルシウム
- 〘 名詞 〙 ( [オランダ語・英語] calcium ) アルカリ土類に属する軽金属元素。銀白色で柔らかく、鉛よりは堅い。天然に遊離しては存在しない。石灰石、白堊(はくあ)、燐灰石などの成分として存在する。また、動物の骨組織の中にも含まれる。記号 Ca 原子番号二〇。原子量四〇・〇七八。
- [初出の実例]「『カルシユム』亦甚純粋の鉱となし難な者なり」(出典:小学化学書(1874)〈文部省〉三)
日本大百科全書(ニッポニカ) 「カルシウム」の意味・わかりやすい解説
カルシウム
かるしうむ
calcium
周期表第2族に属し、アルカリ土類金属元素の一つ。
歴史
金属単体として得られたのはいまから百数十年前であるが、化合物としてはずっと昔から利用されていた。人類は火を使用するようになった時期に、すでに石灰岩(炭酸カルシウム)を知り、その熱分解によって石灰(酸化カルシウムのこと、ラテン語でcalxという。カルシウムの語源はこれに由来する)を得ていたようである。古代において、消石灰(水酸化カルシウムのこと。石灰に水を加えたもの)はモルタルとして石やれんがの接合剤に用いられ、また同様の目的のために石膏(せっこう)(硫酸カルシウム)が使用されたことは1世紀の記録に残っている。大理石(炭酸カルシウム)も以前から知られており、建物、記念碑、彫像の材料として今日まで用いられている。古代の人々はアルカリ土類金属の酸化物を一種の「土」と考えていた。18世紀の終わりごろになっても、当時の科学の方法ではこの「土」をもっと簡単な成分に分解することはできなかった。フランスのラボアジエも1789年に書いた著書『Traité élémentaire de chimie』(『化学原論』)のなかで、酸化カルシウム、酸化ストロンチウム、酸化バリウムなどを元素として分類している。1808年にイギリスのデービーは、水で湿らせた酸化カルシウムと酸化水銀(Ⅱ)との混合物を電解することによって、初めて金属カリウムを単離している。その後1855年に、融解塩化カルシウムの電解による製法がフランスのモアッサンによって考案された。
[鳥居泰男]
存在
カルシウムはきわめて反応しやすい元素であるから、自然界に金属単体として存在できず、2価陽イオンとして化合物をつくっている。元素の地殻中の存在度は、酸素、ケイ素、アルミニウム、鉄に次ぐ大きさである。地殻はケイ酸塩やアルミノケイ酸塩鉱物が主体となって構成されているが、カルシウムがその重要な一成分となっているからである。ケイ酸塩鉱物は、地球の長い地質時代を通じて何十億年という年月の間に、大気中の二酸化炭素や水分、地熱などの作用により破壊され、含まれていたカルシウム分は炭酸塩や硫酸塩となって流出し、石灰石や石膏として堆積(たいせき)した。炭酸カルシウムはきわめて水に溶けにくいが、水が二酸化炭素を含んでいると、次の反応によって水溶性の炭酸水素カルシウムに変わるため、その溶解度は大きくなる。
CaCO3+CO2+H2O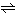 Ca(HCO3)2
Ca(HCO3)2
したがって、海水中や鉱水中にもかなりの量のカルシウムがイオンとなって含まれ、河川の溶解物中20%はカルシウムである。水温が上昇したり、大気中の二酸化炭素の分圧が低下したりすると、二酸化炭素の溶存量が減少するため、前記の平衡は左に移行し、ふたたび難溶性の炭酸カルシウムとなって沈積する。これが海底でおこれば石灰石CaCO3や白雲石CaCO3・MgCO3の層を形成し、石灰洞穴内でおこれば鍾乳石(しょうにゅうせき)や石筍(せきじゅん)(いずれもあられ石構造)となる。海洋生物、たとえば貝、サンゴ虫などは海水中に含まれる炭酸水素カルシウムを分解し、炭酸カルシウムの骨格をつくる。その遺骸(いがい)が海底で長年にわたって沈積したものが白亜である。カルシウムはこのほかフッ化物(蛍石(ほたるいし))、リン酸塩(燐灰石(りんかいせき)など)としても産出する。
カルシウムは動物体内にも存在し、生命の活動に重要な役割を果たしている。貝類など多くの下等動物の殻は炭酸カルシウムでできており、人間など高等動物の骨格の主成分はリン酸カルシウムである。
[鳥居泰男]
製法
工業的には、主として融解塩電解法と熱還元法によって製造される。電解法では無水塩化カルシウムを原料とし、これにフッ化カルシウムまたは塩化カリウムを混ぜて融点を下げ、約800℃で電解が行われる。黒鉛で内張りした鋼鉄製電解槽を用いてこれを正極とし、水冷式鉄電極を負極とする。熱還元法では、高純度の石灰石を焼いて得た石灰を原料とし、これをアルミニウムで還元する。
6CaO+2Al―→3Ca+Ca3Al2O6
この場合にはステンレス鋼製の反応管を用い、真空にして1200℃に加熱。発生したカルシウム蒸気を冷却すると結晶が得られる。いずれの方法によったものでも、真空中で蒸留を繰り返すことにより純度を高められる。
[鳥居泰男]
性質
銀白色の金属で、新しい表面は金属光沢を呈する。その結晶は300℃以下では面心立方構造をとるが、このほかいくつかの結晶変態があり、たとえば450℃以上では六方最密充填(じゅうてん)構造をとる。アルカリ金属に次いで軽く、軟らかさの点ではバリウムや鉛ほどではないが、いくぶんかの展延性をもっている。橙赤(とうせき)色の炎色反応を示す。
同族のストロンチウム、バリウムによく似た化学的性質を示し、性質や構造の類似した化合物をつくるが、一般に反応活性の点ではBa>Sr>Caの順にわずかながら低下している。常温において空気中の酸素、窒素および水と徐々に反応するので、表面が酸化物、窒化物および水酸化物からなる黄灰色の被膜で覆われる。酸素中(または空気中)で加熱すると火を発して燃え、酸化物CaOとなるが、カリウム以下のアルカリ金属のように、過酸化物や超酸化物を生ずることはない。純窒素中で加熱すれば窒化物Ca3N2を生ずる。水素とは400℃以上で徐々に反応して水素化カルシウムとなるが、水素圧が高いとさらに低温でも反応する。このほかハロゲン、リン、硫黄(いおう)、セレンと高温で反応し、炭素、ケイ素、ホウ素とも直接反応する。冷水とは徐々に、温水とは激しく反応して水素を発生し、あとに水酸化物を残す。アルコールとはゆっくりと、また酸とは激しく反応し、水素の発生と同時にアルコキシド(アルコール類のヒドロキシ基の水素を金属で置換した化合物。アルコラートともいう)または塩を生成する。液体アンモニアに溶けて濃青色(溶媒和電子による発色)の溶液を与えるが、アンモニアを蒸発しさると、あとにヘキサアンミンカルシウム錯体[Ca(NH3)6]が残る。気体アンモニア中で熱すれば次の反応がおこる。
6Ca+2NH3―→3CaH2+Ca3N2
水銀とはアマルガムをつくり、多くの有機化合物を還元する。純度の高いカルシウムは暫時ならば空気中で安定であり、さらに不活性ガス雰囲気中や真空中に保存すれば長期間貯蔵ができる。
カルシウムの化合物はストロンチウム、バリウムの化合物とよく似ているが、水に対する溶解度は二、三の例外はあるが、一般にやや大きくなっている。
[鳥居泰男]
用途
金属カルシウムはその還元力の強い点から、バナジウム、チタン、ジルコニウム、トリウム、ウランなど難還元性金属の酸化物、ハロゲン化物から金属を製造するのに使われる。また比較的融点が高く蒸発しにくいので、融解鉄や鋼、その他の金属や合金の脱酸剤、脱硫剤として用いられる。さらにナトリウムで活性化すると窒素と結合しやすくなるので、アルゴン、ヘリウムなど希ガスの精製に利用される。また合金の添加材としても用いられ、鉛、アルミニウム、マグネシウムなどとの合金として各種の用途がある。そのほか、有機合成における還元剤、鉛からのビスマス除去剤、水素化カルシウムの製造原料などとなる。
[鳥居泰男]
人体とカルシウム
カルシウムは人体にとって重要な無機質の一つで、人体に約1.2キログラムと無機質中では最大量含まれている。骨および歯に99%存在し、残りは血液および筋肉に含まれる。骨や歯のカルシウムはリン酸カルシウムとなって硬い組織を構成している。骨は人体の支柱的な役割を果たすとともに、カルシウムの貯蔵庫で、血中カルシウムが少なくなると、骨のなかからカルシウムが出てきて補給し、また余分のカルシウムは骨に戻る。
血液中のカルシウムはほとんどが血清中に存在し、つねにほぼ一定の水準に保たれており、血清カルシウムの多くはイオン化していて、各種の生理作用に関係している。また、血液の凝固性に対しても重要な役割を果たす。カルシウムはまた、心筋の収縮作用、筋肉の運動、神経の刺激伝達、細胞分裂などに関係し、白血球の食菌作用を促して疾病に対する抵抗力を増加するなど、生理的に重要な働きをもつ。また、血中のカルシウムは体液の水素イオン濃度指数(pH)保持にも大きな役割を果たしている。
カルシウムは主として腸内から吸収され、排泄(はいせつ)は尿および腸内の両方から行われる。とくに吸収時にはリンおよびビタミンDが必要とされ、カルシウムとリンの比率がほぼ1対1のときに吸収がよい。極度にリンの比率が大きくなると、カルシウムの吸収は疎外され、それが原因でカルシウム不足を生じることがある。カルシウムの欠乏症には、くる病、骨軟化症、骨粗鬆症(こつそしょうしょう)などが、また、過剰症には腎臓(じんぞう)結石、軟骨繊維石灰化症などがある。
カルシウムを多く含む食品としては、牛乳および乳製品、海藻、葉菜類、豆類、小魚の骨ごとの摂取があげられる。1日の摂取基準は年齢や性別によって異なるが、成人では約600ミリグラム、成長期には成人の1.3~1.5倍が必要である。また、妊婦や授乳婦では、胎児や母乳中にカルシウムが必要なので、不足しないようにやや多めにとることがたいせつである。日本人の栄養調査結果では長年にわたって摂取不足がみられ、食生活指導の重要なポイントになっている。その一方で、サプリメントや添加した加工食品などからの過剰摂取による健康障害が問題視されている。厚生労働省は、そのリスクを下げるために、「日本人の食事摂取基準」を設定し、食事からとるべき目安量や目標量とともに上限量を示している。
[河野友美・山口米子]
『片瀬淡著『新カルシウムの医学』改訂版(1990・人間医学社)』▽『森井浩世編『骨・カルシウム検査ハンドブック』(1996・中山書店)』▽『西井易穂・森井浩世・江沢郁子・小島至編『カルシウムと骨』(2001・朝倉書店)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『菱田明・佐々木敏監修『日本人の食事摂取基準2015年版――厚生労働省「日本人の食事摂取基準」策定検討会報告書』(2014・第一出版)』▽『藤田拓男著『新カルシウムの驚異――人類の未来をささえるカルシウム』(講談社・ブルーバックス)』
カルシウム(データノート)
かるしうむでーたのーと
カルシウム
元素記号 Ca
原子番号 20
原子量 40.08
融点 839℃
沸点 1480℃
比重 1.55(測定温度20℃)
結晶系 立方
元素存在度 宇宙 7.36×104(第13位)
(Si106個当りの原子数)
地殻 4.15%(第5位)
海水 (/mgl-1) 412
改訂新版 世界大百科事典 「カルシウム」の意味・わかりやすい解説
カルシウム
calcium
金属元素の一つ。周期表第ⅡA族に属するアルカリ土類金属の代表的なもので,単体の形では産出しないが,炭酸塩(石灰岩,大理石),硫酸塩(セッコウ),フッ化物(蛍石),リン酸塩(リン鉱石)などとして広く産出し,そのほか地殻を構成する多くのケイ酸塩鉱物の主成分の一つをなす。河川水や海水にもつねに含まれ(海水では400mg/l),また生物体にとっても重要な成分の一つとなっている重要な元素である。カルシウムの単体をはじめて純粋に取り出したのはH.デービーである(1808)。彼は,酸化カルシウムと酸化水銀の混合物を水で湿したものを電解してまずカルシウムのアマルガムを得,これから水銀を蒸留によって取り除くと,銀白色の金属元素が残ることを観察した。この元素は,石灰(酸化カルシウム)のラテン名calxにちなんでカルシウムと命名された。現在,金属カルシウムは,酸化カルシウムをアルミニウムとともに真空中で1200℃近くで還元揮発するか,無水塩化カルシウムを溶融塩電解法で還元して製造する。
生体とカルシウム
脊椎動物の骨や歯は主としてリン酸カルシウムCa3(PO4)2から成る。したがって,骨や歯の形成過程にある小児や妊婦はもちろん,成人でも新陳代謝による損失を補うため,つねにカルシウムを摂取する必要がある。成人で1g/日,授乳期の母親は2~4g/日のカルシウムが必要とされる。サンゴ,貝のような無脊椎動物の殻や骨片はおもに炭酸カルシウムCaCO3であって,これらが海辺や海底に層をつくって堆積したものが,長年月のうちに石灰岩や大理石をつくる。石灰岩の総量は全岩石の0.25%を占め,過去の海産動物が莫大な量のカルシウムを海水中から取り入れたことが知られる。
ヒトなど脊椎動物ではカルシウムの大部分は骨格中にある。残りのカルシウムも,量的には少ないが,さまざまな生理機能の調節にきわめて重要な役割を果たしている。血液中のカルシウムイオンは,血液凝固において,トロンボゲンがトロンビンに活性化されるために必須である。また筋収縮においては,トロポニン-トロポミオシンの系と相互作用することにより神経刺激による筋収縮の制御にかかわっている。カルシウムは細胞運動一般に関与しているほか,細胞と細胞の接着にも必須である。一方,植物においては大量には必要ではないが不可欠な栄養素の一つであり,細胞膜の透過性に関与している。植物の細胞中にはシュウ酸カルシウムなどの結晶としてみられることもある。
性質
銀白色,六方晶系の軟らかい金属(鉛よりは硬い)で,展性・延性がある。空気中,常温で酸化され,熱すれば800℃付近で燃える。反応性が強く,水素,ハロゲン,硫黄,リン,窒素,ケイ素などと直接に化合し,水とは常温ではゆるやかに,熱すれば激しく反応して水素を生ずる。化合物中ではつねに2価の無色の陽イオンCa2⁺となっており,赤橙色の炎色反応を示す。多くの塩は水に溶けるが,硫酸塩は難溶,炭酸塩,リン酸塩およびリン酸一水素塩,ケイ酸塩,フッ化物,多くの有機酸塩は不溶である。
用途
単体は,金属としての用途より,むしろ還元剤として,ウラン,クロム,トリウムなどのフッ化物,塩化物を金属に還元するために用いられる。また,カルシウムを0.5~1.5%含む鉛-カルシウム合金は,析出硬化型の合金で,鉛を硬くし,鉛蓄電池の電極材料にも用いられる。化合物の用途はきわめて多い。石灰岩(炭酸カルシウムCaCO3)は,建築材料のほかセメントやガラスの製造原料,鉄や銅の冶金などに使用され,また生石灰CaOの製造原料となる。カルシウムカーバイド(炭化カルシウムCaC2)はアセチレンの製造原料,石灰窒素(カルシウムシアナミドCaCN2)は窒素肥料,消石灰(水酸化カルシウムCa(OH)2)はモルタルやさらし粉の製造原料,また安価なアルカリとして広く利用されるが,これらはみな生石灰から製造される。建築や彫刻に用いるセッコウCaSO4,肥料として重要なリン鉱石Ca3(PO4)2,水素の発生源や強力な還元剤となる水素化カルシウムCaH2,フッ素の原料となる蛍石CaF2なども,すべてカルシウムの化合物である。また,医療用に塩化カルシウムやグルコン酸カルシウムの水溶液を注射薬として用いるほか,カキ殻を粉末にした漢方薬の牡蠣(ぼれい)をはじめ,きわめて種々の製剤が市販されている。
執筆者:曽根 興三+後藤 佐吉+柳田 充弘
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「カルシウム」の解説
カルシウム
カルシウム
calcium
Ca.原子番号20の元素.電子配置1s22s22p63s23p64s2の周期表2族元素.原子量40.08.6種類の安定同位体(40Ca,42Ca,43Ca,44Ca,46Ca,48Ca)と6種類の放射性同位体が知られている.1808年H. Davy(デイビー)が塩化カルシウムの融解電解により遊離した.Davyは古くから知られている石灰calx(ラテン名)から元素名をとった.宇田川榕菴は天保8年(1837年)の「舎密開宗」のなかで,加爾究母(カルキウム)カルキ,メタールとしている.
天然には遊離状態では存在せず,炭酸塩,硫酸塩,フッ化物,リン酸塩,ケイ酸塩として多量に存在する.地殻中の存在度52900 ppm.海水中に0.04%,河川の溶解物中に20% 含まれている.骨,歯などの主成分である.塩化カルシウムと塩化カリウムの混合物の融解電解により得られ,真空蒸留により精製する.常温では,銀白色の軟らかい金属で展性・延性がある.面心立方格子構造.格子定数a=0.557 nm.250 ℃ 以上で六方最密充填構造,450 ℃ 以上で体心立方格子構造になる.融点839 ℃,沸点1480 ℃.密度1.55 g cm-3(20 ℃).融解熱9.2 kJ mol-1,蒸発熱150 kJ mol-1.炎色反応は橙赤色.常温で酸素,ハロゲンと直接化合する.水と反応して水素を発生し,水酸化カルシウムとなる.塩酸,硝酸,硫酸とはげしく反応し,その酸のカルシウム塩を生じる.高温では酸素,窒素,硫黄,ハロゲン,セレン,リン,ヒ素,炭素,ケイ素,ホウ素と直接化合する.液体アンモニアに溶け,水銀とはアマルガムをつくり,多くの金属と合金をつくる.還元性が強く,多くの有機物や金属酸化物を還元する.高真空用ゲッターに用いられるほか,脱酸剤,脱硫剤,脱りん剤として金属や合金の精錬に,また脱窒素剤として希ガスの精製などに用いられる.還元剤としてはジルコニウム,ウラン,トリウムの製造に用いられる.アルミニウムとの合金は軸受メタルに,鉛との合金はバッテリ用の電極に,マグネシウムとの合金は耐熱合金に用いられる.[CAS 7440-70-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
食の医学館 「カルシウム」の解説
カルシウム
カルシウムは日本人にとって不足の目立つ栄養素です。カルシウムの不足はくる病や骨粗鬆症(こつそしょうしょう)の原因になるほか、神経の興奮を抑える働きが低下して、イライラしやすくなります。また、高血圧症や動脈硬化(どうみゃくこうか)の原因にもなります。
カルシウムは、リンやたんぱく質、塩分の過剰摂取によって吸収を阻害されるので気をつけましょう。逆に、ビタミンDやクエン酸は、カルシウムの吸収を促進します。
可食部100g中に含まれるカルシウムの多い食品として、以下のものがあります。干しエビ7100mg、カタクチイワシ(煮干し)2200mg、サクラエビ(素干し)2000mg、パルメザンチーズ1300mg、炒りゴマ1200mg。成人1日あたりの推奨量は男性650~800mg女性600~650mgです。
百科事典マイペディア 「カルシウム」の意味・わかりやすい解説
カルシウム
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「カルシウム」の意味・わかりやすい解説
カルシウム
calcium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
漢方薬・生薬・栄養成分がわかる事典 「カルシウム」の解説
カルシウム【calcium】
栄養・生化学辞典 「カルシウム」の解説
カルシウム
生活習慣病用語辞典 「カルシウム」の解説
カルシウム
出典 あなたの健康をサポート QUPiO(クピオ)生活習慣病用語辞典について 情報
毛髪用語集 「カルシウム」の解説
カルシウム
出典 抜け毛・薄毛対策サイト「ふさふさネット」毛髪用語集について 情報
世界大百科事典(旧版)内のカルシウムの言及
【骨】より
…脊椎動物の骨格の構成要素,およびその組織。無脊椎動物にも貝類の殻,イカの甲,カニの甲殻などさまざまな骨格が見いだされるが,リン酸カルシウム質の骨は軟骨と並んで脊椎動物独特のものである。脊椎動物がどのようにして骨をもつに至ったかは不明であるが,化石として知られる最古の脊椎動物,すなわち無顎(むがく)類に属した古生代の甲皮類(カブトウオ類)は〈皮甲〉と呼ばれる堅固な骨性の外骨格を備えていた。…
※「カルシウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



