翻訳|benzene
共同通信ニュース用語解説 「ベンゼン」の解説
ベンゼン
無色で引火性の高い化学物質。プラスチックや合成繊維などの原料として広く使われる。たばこの煙のほか、ガソリンにも含まれ、多くの発生源は排ガス。発がん性があり、皮膚の炎症などを引き起こす。高濃度になると中毒症状が出る。都市ガスの製造過程でも生成される。ベンゼンの蒸気が混じった空気に引火すると爆発を起こすこともある。
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
精選版 日本国語大辞典 「ベンゼン」の意味・読み・例文・類語
改訂新版 世界大百科事典 「ベンゼン」の意味・わかりやすい解説
ベンゼン
benzene
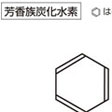
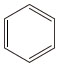
化学式C6H6。ドイツ語Benzolにちなんでベンゾールともいう。特色ある臭気をもつ液体で,最も簡単な芳香族炭化水素。融点5.49℃,沸点80.13℃,密度d240=0.87865g/cm3,屈折率n2D0=1.5011。引火点-11.10℃,爆発限界は空気中で1.4~8.0%(容量)である。燃えやすく大量のすすを生じて燃える。有毒で,ベンゼンと常時接触するか,高濃度の蒸気を吸入すると中毒を起こす。労働環境における大気中許容濃度は25ppmと定められている。
平面正六角形構造で,炭素-炭素間の結合の長さは0.140nmで,2個のsp2混成軌道の炭素による炭素-炭素単結合の長さ(0.148nm)と炭素-炭素二重結合の長さ(0.134nm)の中間である。ベンゼンは不飽和化合物であるにもかかわらず付加反応を受けず,また燃焼熱の測定などから特異の安定性を得ていることがわかっている。これらの性質を総称して芳香族性という。ベンゼンに代表される芳香族化合物の代表的反応は求電子置換反応である(求電子反応)。硝酸または混酸(濃硝酸と濃硫酸の混合物)によるニトロ化では,求電子試薬ニトロニウムイオンNO2⁺がベンゼンのπ電子へ攻撃することによって反応は開始され,シクロペンタジエニルカチオン構造をもつ中間体を経由して生成物ニトロベンゼンとなる。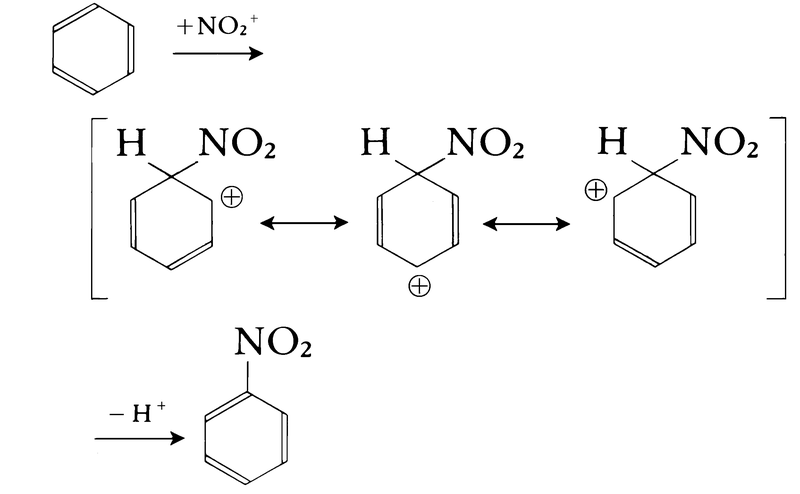
ベンゼンの特異な性質はその物理的性質とくに分光学的性質にも明確に現れる。紫外吸収スペクトルでは,通常の共役二重結合をもつ化合物に共通に現れるKバンド(184nm)のほかに,ベンゼン環に固有な,強度の小さいBバンド(230~270nm)がある(図1)。赤外吸収スペクトルでは,ベンゼンのC-H伸縮振動はアルカンの値(2850~2960cm⁻1)に比べて高波数である(3030cm⁻1付近)。プロトン核磁気共鳴では,ベンゼンではδH=6.5~8.0であり,アルカン(δH=0.8~1.7)はもちろん,アルケン(δH=4.6~5.5)に比べても著しく低磁場である。これはベンゼンの環状π電子がつくる環電流の反遮へい効果のためである。環電流による化学シフトの変化は,芳香族性の最も確かな証拠という。
歴史
ベンゼンは1825年M.ファラデーによって発見された。当時,照明用に用いられたガス灯用ガスの容器の底にたまる液体を精製・分析し,新しい炭化水素を得た。のちにE.ミッチェルリヒはこれを〈ベンジン〉と呼び,また硝酸との反応でニトロベンゼンを,硫酸との反応でベンゼンスルホン酸を得た(1833)。しかしベンゼンの構造そのものは謎につつまれており,1850年代になって,クーパーArchibald Scott Couper(1831-92)はサリチル酸に対して図2-aのような構造式を提案した。しかしこの式は脂肪族炭化水素と比較したときのベンゼンの特異な反応性(すなわち付加が起こりにくく,置換が起こりやすい)を説明できなかった。64年F.A.ケクレは単結合と二重結合が交互に並んで環をつくるいわゆるケクレ構造(図2-b,c)を提案した。ケクレ構造を用いるとサリチル酸は図2-dのように表される。このとき図2-dとは二重結合の位置だけが異なる図2-eとの関係が問題になる。ケクレはベンゼンの場合図2-dと図2-eの間の共鳴で説明できると考えた。これに対する実験的証明はケルナーWilhelm Körner(1839-1925)によって与えられた。彼はベンゼン置換体(トリブロモベンゼンやジブロモニトロベンゼン)の位置異性体数はケクレ構造および共鳴を考慮した予想値と一致することを,合成,単離,構造決定を行って証明した。ベンゼンの平面正六角形構造は,誘導体やそれ自身のX線結晶解析,気体電子線回折などの手法により1930年代に実験的に確証された。ベンゼンが,単純なシクロヘキサトリエンすなわち単純に単結合と二重結合とが交互にならんだ環式構造 では説明できない一種の安定性をもっていることは,その燃焼熱の測定などから知られていたが,その理論的な裏付けとして,安定化エネルギー(共鳴エネルギー)の量子力学による評価が古くヒュッケルErich Armand Arthur Joseph Hückel(1896-1980)によって試みられ(1936),その後もL.C.ポーリングらによってなされている。
では説明できない一種の安定性をもっていることは,その燃焼熱の測定などから知られていたが,その理論的な裏付けとして,安定化エネルギー(共鳴エネルギー)の量子力学による評価が古くヒュッケルErich Armand Arthur Joseph Hückel(1896-1980)によって試みられ(1936),その後もL.C.ポーリングらによってなされている。
→共鳴
ケクレ構造以外のベンゼンの構造
ケクレ構造が提案されたとき,当時の化学者は必ずしもそれに満足したわけではなく,多数の異なる構造が提案された。このなかではパラ結合を含むデュワーの構造(デュワーベンゼン,図3-a),ラーデンブルグAlbert Ladenburg(1842-1911)のプリズム構造(プリズマン,図3-b),三つのパラ結合をもつクラウスの構造(図3-c)などが著名である。これらはいずれもケクレ構造に比べて,実験事実に一致しない点が多かった。しかしながら1960年代になると,これらの非ケクレ構造をもつベンゼンのあるものは,置換基の種類によっては単離できるほど安定に存在しうることがわかった。この種のベンゼンの構造異性体のほか,トロポロンなどのベンゼン環をもたないが芳香族性をもつ化合物は,非ベンゼン系芳香族化合物と総称されるようになった。
製法
昔は石炭乾留の副産物としてガス軽油から分離,精製されてつくられたが,現在はもっぱら石油化学工業においてナフサの改質反応(芳香族化反応)によって,あるいは高温熱分解の併産物として,石油から生産されている。ナフサの改質反応は,白金系の触媒上で水素の共存下に約500℃,10~35気圧の条件下で行われる。改質油はジエチレングリコール,スルホランなどを溶剤として抽出処理され,トルエン,キシレンなどとともにベンゼンを回収し,蒸留によってこれらを分離する。ナフサの高温熱分解ではオレフィンとともに芳香族が生産される。このプロセスの生成油を水素化してジエン類などのオレフィンを除いたのち,溶剤抽出と蒸留によってベンゼンなどの芳香族を回収する。
用途
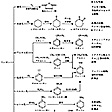
合成繊維,合成ゴム,染料,医薬などの原料として有機合成化学工業の最も重要な出発物質の一つである。工業上重要な誘導体とその製品を図4に示す。
執筆者:竹内 敬人+冨永 博夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「ベンゼン」の意味・わかりやすい解説
ベンゼン
べんぜん
benzene 英語
Benzol ドイツ語
代表的な芳香族炭化水素で、炭素原子6個が正六角形の6員環をなしている典型的な芳香族化合物である。ベンゾールとよばれることもある。さらに、古くはドイツでベンジンBenzinとよばれていたが、この名前は安息香酸benzoic acidを石灰とともに蒸留して得たことに由来し、E・ミッチェルリヒが命名した(1883)。benzeneという綴字(つづりじ)はA・W・ホフマンによるといわれる。
[向井利夫・廣田 穰 2016年2月17日]
性質と構造
特有のにおいをもつ無色透明で可燃性の液体で、煤(すす)の多い黒い煙をあげて燃える。その蒸気は有毒である。水には難溶だが、エタノール(エチルアルコール)やエーテルとは任意の割合で混じり合う。大気中のベンゼンは有害大気汚染物質と定められていて、長期間吸収すると造血器の障害をおこし、貧血などの原因になる。白血病などの癌(がん)性疾患を引き起こすともいわれている。
1825年にイギリスのM・ファラデーにより、鯨油の赤熱分解で得られたガスを凝縮させた液体中から最初に発見され、発見当時からその構造と化学的特性に関心が集まった。1865年、ドイツのF・A・ケクレが有名な亀甲(きっこう)形の六角環状説(ベンゼン環)を提案したが、最終的には1930年代になって、ようやくX線および電子線回折測定により正確な構造が決められた。それによると、ベンゼン環は1辺が0.1399ナノメートルの正六角形で、6本の炭素‐炭素(C-C)結合はまったく同等であり、6個のπ(パイ)電子が3本の二重結合に2個ずつ局在化しているのではなく、6個の炭素に平等に共有され、非局在化していることが証明された。ベンゼンの構造、性質が解明される過程において芳香族化合物の化学は発展し、この意味でも化学に果たした役割は非常に大きい。
[向井利夫・廣田 穰 2016年2月17日]
製法
石炭タールまたは石油から製造されている。しかし、芳香族炭化水素の石油中に含まれる量は少ないので、石油化学工業ではナフサの接触分解、リホーミングによりベンゼンのみならずトルエン、キシレンを含む炭化水素油をつくり、これから分留してベンゼンを製造する。またアルキルベンゼンのような高級同族体からは、脱アルキル化、水素化分解法によりベンゼンを得ている。
[向井利夫・廣田 穰 2016年2月17日]
反応
芳香族性として知られているπ電子の非局在化によりベンゼン環が安定化していて壊れにくいので、ベンゼン誘導体はベンゼン環が失われる付加反応ではなく、反応の後にもベンゼン環が残る置換反応をおこしやすいという特徴がある。ベンゼンの置換反応としては、次の(1)~(4)などが代表的であり、これらの反応はいずれもベンゼン置換体の重要な合成法である。
(1)硝酸と硫酸混合物によるニトロベンゼンの生成(ニトロ化)
(2)発煙硫酸によるベンゼンスルホン酸の生成(スルホン化)
(3)鉄粉を触媒とする塩素、臭素などのハロゲンとの反応によるクロロベンゼンやブロモベンゼンの生成(ハロゲン化)
(4)塩化アルミニウムを触媒としたアルキル化によるアルキルベンゼンの生成、ならびにアシル化によるアセトフェノンなどの芳香族ケトンの生成(フリーデル‐クラフツ反応)。
これら(1)~(4)の反応では陽イオン試薬がπ電子(負電荷)をもつベンゼン環に反応しているので、芳香族求電子置換反応と総称されている。
しかし、次の(5)~(7)の例のように、高温、高圧といった強い反応条件下では、ベンゼン環への付加やベンゼン環が開環する反応もみられる。
(5)白金触媒やニッケル触媒を用いる水素化によるシクロヘキサンの生成
(6)接触気相酸化による無水マレイン酸などの合成
(7)光を照射しながら塩素を反応させてBHC(ベンゼンヘキサクロリドの略、別名1,2,3,4,5,6-ヘキサクロロシクロヘキサン)を得る反応。
[向井利夫・廣田 穰 2016年2月17日]
用途
各種化学製品の中間体製造のための出発原料として重要である。ベンゼンはアルキルベンゼン、フェノール、アニリン、スチレン、クロロベンゼン、ニトロベンゼン、無水マレイン酸などの合成原料であり、これらからさらに各種の樹脂、繊維、洗剤、染料、殺虫剤、爆薬、医薬品などが誘導される()。
[向井利夫・廣田 穰 2016年2月17日]
『山岡望著『化学史談5・ベンゼン祭』(1958・内田老鶴圃)』▽『吉田善一・大澤映二著『化学モノグラフ22 芳香族性』(1971・化学同人)』▽『中西準子・吉門洋・川崎一・東野晴行著『詳細リスク評価書シリーズ18 ベンゼン』(2008・丸善)』
ベンゼン(データノート)
べんぜんでーたのーと
ベンゼン
分子式 C6H6
分子量 78.1
融点 5.533℃
沸点 80.099℃
密度 0.87865g/cm3(測定温度20℃)
屈折率 (n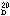 )1.50112
)1.50112
融解熱 30.1cal/g
蒸発熱 93.84cal/g(沸点)
引火点 -11.10℃
爆発限界 1.4~8.0容量%(空気中)
溶解度 1.8g/L水(15℃)
化学辞典 第2版 「ベンゼン」の解説
ベンゼン
ベンゼン
benzene
benzole.C6H6(78.11).石油改質中に,また石炭を乾留したときのガスおよびタール中に多量に含まれ,工業的にこれらから分離,精製する.すなわち,石油精製工業においては,ナフサを接触改質してベンゼン,トルエン,キシレンなどの芳香族炭化水素に富む改質油にかえ,スルホラン法,その他によって芳香族のみを抽出し,さらに分留してトルエン,キシレン,そのほかの留分と分ける.また,トルエンやキシレンの脱メチル水素化法で製造するときには,Cr2O3,Mn2O3,CoOなどの担持触媒による接触反応で処理し,メチル基をメタンとして除去して製造される.ベンゼンは,芳香族炭化水素の代表的な化合物であり,芳香族特有の香りをもつ,無色,揮発性の液体で,人体には有毒である.融点5.5 ℃,沸点80.1 ℃.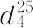 0.8737.
0.8737.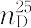 1.4979.比熱容量1.734 J K-1 mol-1(21.8 ℃).蒸発熱392.6 J g-1(沸点).引火性が強く引火点-11.10 ℃.λmax 198,256 nm(ε 8000,230).エタノール,エーテルなど多くの有機溶媒に可溶,水に難溶.水29.6物質量% で沸点69.25 ℃(101 kPa)の最低共沸混合物をつくる.ベンゼンの構造は正六角形の平面であり,C-C0.1397 nm,C-H0.1084 nm,∠C-C-Cおよび∠H-C-Cはすべて120°である.
1.4979.比熱容量1.734 J K-1 mol-1(21.8 ℃).蒸発熱392.6 J g-1(沸点).引火性が強く引火点-11.10 ℃.λmax 198,256 nm(ε 8000,230).エタノール,エーテルなど多くの有機溶媒に可溶,水に難溶.水29.6物質量% で沸点69.25 ℃(101 kPa)の最低共沸混合物をつくる.ベンゼンの構造は正六角形の平面であり,C-C0.1397 nm,C-H0.1084 nm,∠C-C-Cおよび∠H-C-Cはすべて120°である.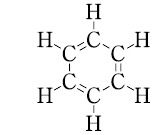 ベンゼンは化学的に安定な化合物であるが,強力な試薬によって置換反応および付加反応を受ける.とくにニトロ化,ハロゲン化,スルホン化,あるいはフリーデル-クラフツ反応のような親電子置換反応は,ベンゼンの代表的な反応であり,これによってきわめて多種類の置換ベンゼン誘導体が合成され,これらは芳香族系合成化学,ならびにその工業の中間物として重要なものが多い.付加反応においては,塩素をラジカル的に付加させるとヘキサクロロシクロヘキサン(BHC)となり,水素を付加させるとシクロヘキサンが得られる.また,ニトロベンゼン,クロロベンゼンを経て多数のベンゼン誘導体に導き,染料,医薬,農薬などの中間物として用いられる.LD50 3800 mg/kg(ラット,経口).[CAS 71-43-2]
ベンゼンは化学的に安定な化合物であるが,強力な試薬によって置換反応および付加反応を受ける.とくにニトロ化,ハロゲン化,スルホン化,あるいはフリーデル-クラフツ反応のような親電子置換反応は,ベンゼンの代表的な反応であり,これによってきわめて多種類の置換ベンゼン誘導体が合成され,これらは芳香族系合成化学,ならびにその工業の中間物として重要なものが多い.付加反応においては,塩素をラジカル的に付加させるとヘキサクロロシクロヘキサン(BHC)となり,水素を付加させるとシクロヘキサンが得られる.また,ニトロベンゼン,クロロベンゼンを経て多数のベンゼン誘導体に導き,染料,医薬,農薬などの中間物として用いられる.LD50 3800 mg/kg(ラット,経口).[CAS 71-43-2]
(ジクロロヨード)ベンゼン
ジクロロヨードベンゼン
(dichloroiode)benzene
C6H5ICl2(274.90).ヨードベンゼンジクロリド(indobenzene dichloride),フェニルヨウ素(Ⅲ)ジクロリド(phenyliodine(Ⅲ) dichloride)ともいう.低温でヨードベンゼンに乾燥塩素ガスを作用させると得られる.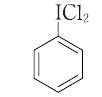 黄色の結晶.融点115~120 ℃(分解).二重結合,三重結合と反応して塩素付加体を与えるが,塩素とは異なる選択性を示す.第二級アルコールをケトンへ酸化,また,オキシムをカルボニル化合物に変換できる.光照射下では炭化水素を塩素化でき,この反応を応用して,ステロイドなどに位置選択的に塩素を導入する方法も開発されている.[CAS 932-72-9]
黄色の結晶.融点115~120 ℃(分解).二重結合,三重結合と反応して塩素付加体を与えるが,塩素とは異なる選択性を示す.第二級アルコールをケトンへ酸化,また,オキシムをカルボニル化合物に変換できる.光照射下では炭化水素を塩素化でき,この反応を応用して,ステロイドなどに位置選択的に塩素を導入する方法も開発されている.[CAS 932-72-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「ベンゼン」の意味・わかりやすい解説
ベンゼン
→関連項目環境基準|工業中毒|ごみ公害|石炭化学|石油化学|染料|タール染料|DDT|ベンゼン中毒
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ベンゼン」の意味・わかりやすい解説
ベンゼン
benzene
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「ベンゼン」の解説
ベンゼン
溶剤や化学合成の原料などに利用される.
世界大百科事典(旧版)内のベンゼンの言及
【化学工業】より
…コークスや石炭ガス需要が増大するにつれ,それまで廃物として取扱いに困っていたコールタールを有効に利用することが考えられるようになった。A.W.vonホフマンを中心にコールタールの分析が進み,芳香族炭化水素であるベンゼンが発見された。1856年には弟子の一人であるW.H.パーキンが,ベンゼンからアニリン染料〈モーブ〉を合成するのに成功した。…
【石炭化学工業】より
…石炭化学工業とは,化学工業のなかで石炭を原料として各種の化学製品を生産する産業で,石炭を乾留して得られる石炭ガス,コークス,コールタールを原料とするものと,石炭をガス化して原料とするもの,の二つに大別することができる。おもな製品としては,石炭ガスからつくられるBTX類(ベンゼン,トルエン,キシレン),コールタールからつくられるピッチ,クレオソート油などがある。なおコークスからカーバイドを経てアセチレンを生産する産業は,電気化学工業の範疇(はんちゆう)に入る。…
※「ベンゼン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
[名](スル)1 人から受けた礼・贈り物に対して行為や品物で報いること。また、その行為や品物。「地酒を贈って返礼する」2 仕返しをすること。また、その仕返し。意趣返し。返報。[補説]書名別項。→返礼[...