翻訳|zinc
精選版 日本国語大辞典 「亜鉛」の意味・読み・例文・類語
あ‐えん【亜鉛】
日本大百科全書(ニッポニカ) 「亜鉛」の意味・わかりやすい解説
亜鉛
あえん
zinc
周期表第12族に属し、亜鉛族元素の一つ。地殻中には広く分布しているが、存在量はさほど多くない。遊離した金属としては産せず、主要鉱石は閃亜鉛鉱(せんあえんこう)ZnS、菱亜鉛鉱(りょうあえんこう)ZnCO3、異極鉱(いきょくこう)Zn4(OH)2Si2O7・H2Oなどである。
[中原勝儼]
歴史
亜鉛と銅の合金である真鍮(しんちゅう)(黄銅)はきわめて古くから知られ、紀元前4000年ごろにも使われていた痕跡(こんせき)がある。亜鉛の含有量の少ない真鍮は黄金色で美しく、しかも機械的性質が優れていて、広く使われており、古代ローマで貨幣に使われていた記録もある。しかし金属亜鉛として取り出されたのは、それよりかなりあとであり、インドないし中国で製錬法が発展したとされており、中国には古い亜鉛の貨幣や装飾品が残されている。17世紀前半にはヨーロッパに伝わり、18世紀にはイギリスで製錬工場が設立され、以後、大規模製造が行われるようになった。中国の古い産業技術書『天工開物(てんこうかいぶつ)』(1637)には「倭鉛」と記されており、日本では宇田川榕菴(うだがわようあん)の『舎密開宗(せいみかいそう)』(1837~1847)には「聖究母(ジンキユム)、亜鉛」と記されている。
[中原勝儼]
製法
閃亜鉛鉱が主要原料であるが、まず鉄、鉛などの不純物を浮遊選鉱法などにより除き精鉱とする。ついでこれを酸化燃焼して焼鉱(酸化物)とする。焼鉱を処理するのには乾式法と湿式法がある。乾式法では、コークスを混ぜて耐火粘土製のレトルトの中で約1300℃で加熱還元すると生ずる亜鉛を蒸留する。冷却して得られる粗亜鉛は純度約98.5%でスペルターといっている。おもな不純物は、普通、鉄、鉛、カドミウムなどであって、再蒸留すると99.99%程度の純度となる。この方法で得られたものを蒸留亜鉛という。湿式法は硫酸酸性水溶液中で電解精錬する方法である。すなわち、焼鉱を電解廃液の硫酸で処理して亜鉛を抽出し、不純物を沈殿させるなどして除き、陽極に不溶性の鉛板、陰極には亜鉛あるいはアルミニウム板を用いて電解し、陰極板上に析出させる。この方法で得られたものを電解亜鉛という。電解法は高純度製品を得るのに適し、99.99%ないし99.998%の純度の製品が得られる。
[中原勝儼]
性質
亜鉛は銀白色の青みを帯びた金属で、融解しやすく、また揮発しやすい。結晶構造は六方最密格子。ややもろく加工しにくいが、100~150℃で展性、延性が著しく増大し、薄板、線に加工することが容易になる。200℃以上ではふたたびもろくなり、粉末にすることもできる。電気抵抗率5.916×10-6Ω・cm(20℃)。反磁性。乾燥した空気中では安定であるが、湿った空気中あるいは空気の存在下の水中では、徐々に反応して水酸化物となる。
2Zn+2H2O+O2
―→2Zn(OH)2
また通常の空気中では二酸化炭素が存在するため、表面のみが酸化されて塩基性炭酸亜鉛の灰白色の密な薄い膜をつくり、これが内部を保護する。純度が高いほど空気中では酸化されにくい。空気中で強熱すると緑色を帯びた白色光を放ち、燃焼して酸化物となる。赤熱状態では水蒸気や二酸化炭素からも酸素を奪って水素、一酸化炭素とする。アンモニアでは窒化物となる。粉末の亜鉛は硫黄(いおう)と高温で直接反応して硫化物になり、また乾燥したフッ素、臭素などのハロゲンとは水分が存在するときは反応してハロゲン化物となるが、水素、窒素、炭素とは高温でも反応しない。ハロゲン化水素酸、希硫酸など酸化力の弱い酸には、水素を発生して溶けて亜鉛の塩の水溶液となる。酸化力の強い硝酸や濃硫酸ではよく溶けるが、濃度によって酸化窒素、窒素、アンモニアなどを発生する。たとえば希硝酸では、
4Zn+10HNO3―→
4Zn(NO3)2+NH4NO3+3H2O
のようになる。
濃アルカリ水溶液とは熱すると水素を発生して亜鉛酸塩を生ずる。
Zn+2KOH+2H2O―→
K2[Zn(OH)4]+H2
またアンモニア水、シアン化カリウム水溶液などにも水溶性錯塩をつくって溶ける。
ほとんどの亜鉛化合物の酸化数は+Ⅱである。酸化物および水酸化物は両性化合物で、酸にもアルカリにも溶ける。またd電子殻(化学結合に関与する電子軌道のうちd軌道の構成する電子殻。d電子殻が不飽和のイオンの化合物は有色であることが多い)は完全に充填(じゅうてん)されているため、化合物は一般に無色である。マグネシウム化合物と同形の化合物をつくりやすい。錯イオンの配位形式は四面体型4配位、八面体型6配位である。
[中原勝儼]
用途
薄い鉄板上に亜鉛の薄層を被覆したトタンは、鉄よりもイオン化傾向の高い亜鉛で鉄を覆うことによって鉄の腐食を防ぐようにしたものであり、屋根板や各種容器などに広く用いられている。真鍮は銅との合金で、色調が美しく、鋳造、加工が容易で、展性、延性などの機械的性質に優れているので、線、板、管、その他として機械、日用品、工芸品などに用いられている。また少量のアルミニウム、銅などとの合金である亜鉛ダイカスト合金(たとえば、Al3.5~4.5%、Cu0.75~1.25%、Mg0.02~0.08%、残りがZn)は、自動車部品、計器などの部品として用いられ、そのほか洋銀(洋白)などの合金として用いられる。亜鉛末は金、銀の湿式製錬法の青化法での沈殿剤である。希酸と反応させると水素が発生する。この発生期の水素は還元剤として用いられ、アルキル化合物は有機合成用の試薬として重要である。
[中原勝儼]
人体と亜鉛
亜鉛は人体に約2グラム含まれ、食事から摂取する必要のある微量無機質の一つである。200種以上の酵素の構成成分で、酵素作用に大きく関係している。亜鉛が不足すると、成長障害、肝胆道疾患、免疫機能低下、味覚障害、皮膚炎などが生じる。亜鉛は糠(ぬか)や胚芽(はいが)、豆類、種実などに多く含まれるが、外部化(外食、市販総菜、加工食品などの利用増加)などの食生活の変化により不足ぎみである。食事からとるべき量については、「日本人の食事摂取基準」(厚生労働省)により、目安量や推奨量、および過剰摂取による健康障害のリスクを下げるための上限量が設定されている。
[山口米子]
『落合栄一郎著『生命と金属』(1991・共立出版)』▽『鈴木継美・和田攻編『ミネラル・微量元素の栄養学』(1994・第一出版)』▽『『消化器の臨床――亜鉛の臨床Vol.2-No.1』(1999・ヴァンメディカル)』▽『前野昌弘著『演習形式で学ぶ やさしい無機化学』(1999・裳華房)』▽『内田希・小松高行・幸塚広光・斎藤秀俊・伊熊泰郎・紅野安彦著『無機化学』(2000・朝倉書店)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『日本化学会編『実験化学講座18/有機化合物の合成』第5版(2004・丸善)』▽『菱田明・佐々木敏監修『日本人の食事摂取基準2015年版――厚生労働省「日本人の食事摂取基準」策定検討会報告書』(2014・第一出版)』
亜鉛(データノート)
あえんでーたのーと
亜鉛
元素記号 Zn
原子番号 30
原子量 65.39
融 点 419.6
沸 点 907℃
比 重 7.133(測定温度20℃)
結晶系 六方
元素存在度 太陽系中(Si106個当りの原子数)
1.26×103(第24位)
地殻 80ppm(第24位)
海水(/μgL-1) 0.35
改訂新版 世界大百科事典 「亜鉛」の意味・わかりやすい解説
亜鉛 (あえん)
zinc
周期表第ⅡB族に属する金属元素。天然に遊離の状態では存在しないが,地殻中に広く分布し,また生体に必須の微量元素でもある。亜鉛が合金(黄銅)として使われたのは紀元前からであったが,単体として鉱石から分離して利用したのはインドが最初である。1380年代インド,ラージャスターン州のザワール鉱山ではレトルト蒸留法で亜鉛を作っていた。そして17世紀から18世紀にかけては多量の亜鉛がアジアからヨーロッパに輸出された。ヨーロッパでは18世紀になって初めて作られた。日本では大正時代の初めに工業的に作られ,現在に至っている。zincの名称の由来ははっきりしない。
執筆者:後藤 佐吉
性質
銀白色の光沢のある金属であるが,湿った空気中では表面が酸化されて塩基性炭酸亜鉛の皮膜を生じるため,徐々に金属光沢を失う。その状態が鉛に似ていることに,亜鉛の日本名が由来している。結晶構造は,ひずんだ六方最密格子をもち,6回軸の方向にやや延びている。常温ではややもろく,100~150℃では展性,延性が増大し箔や線に加工することができる。200℃以上になると再びもろくなり,砕いて粉末にすることができる。融点,沸点ともに金属の中では低いのが特徴で,精製法の一つとして蒸留法が利用されるほどである。モース硬度は2.5で,あまり硬くない。標準酸化還元電位は-763mV(25℃)でかなり低く,イオン化傾向が大きい。したがって酸化されて2価イオンになりやすく,反応性が大きい。空気中では徐々に酸化されて酸化物ZnOとなる。薄い酸にもよく溶けて水素を発生する。濃硝酸や濃硫酸のような酸化性の強い酸を還元して,それぞれ窒素酸化物や硫黄酸化物を生成して溶ける。濃アルカリ水溶液,アンモニア水,塩化アンモニウム水溶液には,とくに加熱すると溶けやすい。イオンZn2⁺の半径がマグネシウムイオンMg2⁺の半径に近いためもあって,その化合物の型,化学的性質などはマグネシウム化合物に類似した点が多い。しかし塩基性が弱いので金属は濃アルカリにもおかされる。Zn2⁺は四面体型の四配位錯体(たとえば[Zn(NH3)4]2⁺など)を作る傾向が強い。ハロゲン,硫黄,セレンなどと直接化合物を作る。また,ジメチル亜鉛Zn(CH3)2,ジエチル亜鉛Zn(C2H5)2など亜鉛の有機金属化合物は有機合成に利用される。
執筆者:水町 邦彦
生体と亜鉛
生体中に亜鉛が欠乏すると発育異常のおこることがネズミやニワトリで知られている。高等植物においても葉に特徴的な病斑が現れる。動物の赤血球中の酵素カルボニック・アンヒドラーゼ(二酸化炭素の水和と運搬に関与する)に含まれ,また酵母アルドラーゼの活性化,アルコールデヒドロゲナーゼ,ペプチダーゼなどの微量成分として酵素分子の活性中心を形成するうえで重要である。また動物細胞の核中に微量ながら広く分布しており,細胞分裂に関係があるとも考えられている。
執筆者:柳田 充弘
用途
上述のように亜鉛はイオン化傾向が大きく,したがって他のイオン化傾向の小さい金属と接触させて水中に置くと,自分が溶け出して,他金属の腐食を防ぐ。このような性質を利用して,どぶ漬亜鉛めっき,トタン,その他防食用に利用される。トタンは,鉄板に薄く亜鉛めっきしたもので,建築用材料その他に広く使用されている。どぶ漬亜鉛めっきは,鉄製器具を溶融亜鉛に浸して,表面に亜鉛をつけたものである。そのほか,最近は,船,橋,ドックなど海水(または淡水)につねに接する鉄の構造物の防食用として,めっきではなく,一定間隔で亜鉛のブロックを鉄の表面にボルト止めして使用することも行われている。銅と亜鉛の合金は黄銅またはシンチュウ(真鍮)といわれ,古くから用いられている銅合金で,切削性がよく,さびにくい。ダイカスト用亜鉛合金としても使用される。
→亜鉛合金
製法
亜鉛鉱として最も重要なものはセン亜鉛鉱ZnS(方鉛鉱PbSとつねに共生する)であるが,セン亜鉛鉱の鉱床の酸化帯では,リョウ亜鉛鉱ZnCO3または異極鉱Zn4(OH)2Si2O7・H2Oが重要な鉱物となっている鉱山もある。日本のおもな亜鉛鉱山はすべてセン亜鉛鉱を主体とする。またセン亜鉛鉱には必ずカドミウムが随伴する(亜鉛に対し約1/100~1/200)。亜鉛製錬の際のカドミウムの挙動が問題になっている現在,完全に回収することが重要である。鉱山から採掘された鉱石は,破砕,粉砕後,浮遊選鉱で,脈石,銅鉱物,鉛鉱物などと分離され,亜鉛を50~58%含む亜鉛精鉱とされる。亜鉛精鉱を原料として金属亜鉛を作る製錬法には乾式法と湿式法とがある。
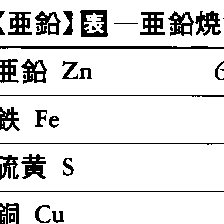
(1)乾式製錬法 亜鉛精鉱を焙焼(ばいしよう)して酸化亜鉛ZnOとし,これを炭素材で還元し,亜鉛を揮発回収して蒸留亜鉛を作る方法で,このようにして得られた焼鉱の分析値の一例を表に示す。乾式法には,水平レトルト蒸留法,立形レトルト蒸留法,電熱蒸留法,ISP法(Imperial Smelting Process)などがある。ISP法を除けば,いずれも焼結塊を固体の炭素で還元して,亜鉛を揮発し,コンデンサーで凝縮回収する方法である。
ZnO+C─→Zn(気体)+CO
この反応は吸熱反応であるので,外部から熱を供給する必要がある。電熱蒸留は焼結塊とコークスを抵抗体として電熱で加熱,水平および立形蒸留ではレトルトの外部から間接的に加熱する。
水平レトルト法は,バッチ操業であり,多量の労力を必要とし能率が悪い。立形レトルト法は,これを改良して,半連続的に上から原料を装入し,下から反応の終わったものを取り出そうとするものである。電熱蒸留法は内熱式の亜鉛蒸留炉であり,蒸留炉自体の熱効率は他の炉よりよいといえるが大量の電力を必要とする。
従来,亜鉛の還元製錬は溶鉱炉では理論的に不可能であるとされてきた。しかし,イギリスのインペリアル・スメルティング社の技術研究グループは,この方式を再検討し,ISP法と呼ばれる非常に巧妙な方法を考案,1958年に操業を開始し,その後,世界の各地でこの方法による工場が作られてきた。この方法では,溶鉱炉から出る含亜鉛ガスを鉛のシャワーで急冷し,ガス中の炭酸ガスCO2による亜鉛の再酸化を防ぐとともに,鉛中に亜鉛を溶解させ,この鉛を系外に取り出し,冷却して亜鉛を析出させ,再び鉛は循環される。
蒸留法で作られた亜鉛は,おもに鉛,カドミウムを不純物として含み,高純度を必要とする用途では,これらを精留して除く必要がある。とくにダイカスト用には,鉛,カドミウムは粒界腐食を起こす原因とされている。亜鉛,鉛,カドミウムの沸点はそれぞれ907℃,1744℃,765℃であり,カドミウムは亜鉛より揮発しやすく,また鉛は揮発しにくいので,これらを分別蒸留する方法が工業的に行われている。
(2)湿式製錬法 焼鉱を硫酸に溶かして得られる硫酸亜鉛の水溶液を,陰極にアルミニウム,陽極に鉛(銀を1%含む)を用いて電気分解し,陰極上に亜鉛を析出させる方法である。このとき陽極からは酸素を発生する。99.99%以上の高純度亜鉛を作ることができるが,亜鉛1t当り約3500kWhの電力を必要とする。
執筆者:後藤 佐吉
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「亜鉛」の解説
亜鉛
アエン
zinc
Zn.原子番号30の元素.周期表12族典型元素.原子量65.409(4).質量数64(48.63%),66(27.90%),67(4.10%),68(18.75%),70(0.62%)の安定同位体と,54~83の間に25種の放射性同位体が知られている.黄銅,青銅は古代アッシリア,ペルシアの時代から知られていたが,単体は,1749年ドイツのA. Marggrafがカラミンとして知られていたりょう亜鉛鉱からはじめて単離した.英語元素名の原型zincumという言葉は,16世紀の錬金術師Paracelsusによって,亜鉛鉱石を炉で溶かしたときの堆積の形から,とがった先端を意味する古代高地ドイツ語のzinkからとされる.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,zincumを音訳して聖究母(シンキュム)とし亜鉛の元素名としている.亜鉛は,正徳3年(1713年)の「和漢三才図絵」にはじめて中国渡来の鉛に似た金属の名称として現れる.真ちゅう(黄銅)は,天平年間に法隆寺の香炉の材料として,中国名「鍮石」が記録されている.
地殻中の存在度80 ppm.遊離金属としては天然には産出しない.おもな鉱石はせん亜鉛鉱ZnS,りょう亜鉛鉱ZnCO3がある.亜鉛鉱石の埋蔵量は,オーストラリア,中国,アメリカ,カザフスタンの4国で全世界の確認埋蔵量の約60% を占める.日本では花岡鉱山(秋田県),神岡鉱山(岐阜県),豊羽鉱山(北海道)などから供給されていたが,採算性鉱量の枯渇により,1980年代から次々閉山され,100% 海外依存となった.地金および精鉱として輸入されるが,鉱石の主要輸入先は,オーストラリア,ペルー,アメリカで70% を占める(2003,2004年).
亜鉛の製錬には乾式法(蒸留亜鉛)と湿式法(電気亜鉛)とがある.乾式製錬法では,硫化鉱をばい焼して酸化亜鉛とし,炭素によって還元して金属とする.密閉レトルト中で1100~1300 ℃ に加熱して,蒸留される亜鉛を凝縮する古典的な製法にかわり,イギリスで開発された.溶鉱炉を用いて亜鉛-鉛混合鉱をコークスと反応させ,発生した亜鉛蒸気を溶融鉛で急冷して液体とし,比重の差により分離し,亜鉛,鉛を同時回収する溶鉱炉法が,高い生産能力や,亜鉛鉱中に含まれる貴金属の回収が容易などの利点から主力となった.湿式法では,酸化亜鉛を希硫酸で浸出し,得られた硫酸亜鉛の希硫酸溶液を電気分解して金属を得る.現在,電解法による電気亜鉛が主である.
やや青味を帯びた銀白色の六方最密格子.密度7.133 g cm-3.融点419.58 ℃,沸点907 ℃.定圧モル熱容量25.48 J K-1 mol-1(25 ℃).線膨張率//C軸0.530×10-4 K-1.⊥C軸0.150×10-4 K-1(20~250 ℃).熱伝導率121 W m-1 K-1(27 ℃).融解熱6.57 kJ mol-1(420 ℃).蒸発熱114.8 kJ mol-1(907 ℃).電気抵抗率5.916×10-6 Ω cm(20 ℃).第一イオン化エネルギー906.2 kJ mol-1(9.39 eV)通常の酸化数2.標準電極電位(Zn2+/Zn)-0.763 V.硬さ2.5.比較的反応しやすい金属.空気中で薄い炭酸水酸化物塩皮膜を表面に生じ,内部までは侵されない.空気中で燃焼すると青緑色の炎をあげて燃え,酸化物を生じる.赤熱状態では水を分解して水素を発生する.乾いたハロゲンとは反応しないが,水分があれば容易に侵される.水素,窒素,炭素とは高温でも直接反応しない.粉末の状態で硫黄と反応し,硫化亜鉛を生じる.希酸に易溶で,酸化力のない酸の場合は水素を発生するが,硝酸の場合には,酸の濃度により酸化二窒素,窒素,ヒドロキシルアミンやアンモニアを生じる.濃アルカリ水溶液と加熱すると水素を発生し,亜鉛酸塩となる.
おもな用途は,国内では自動車用と建材用の亜鉛めっき鋼板向けで50% を超す.ついで,電子機器の板材その他に用いられる真ちゅう,青銅など銅合金用が約25%,自動車部品,模型などに使われるダイカスト用が10%,酸化亜鉛を主とする化学薬品9%,乾電池ほか電池向け1% など.
生体必須元素の一つであるが,大量に摂取すると呼吸器や消化器に障害を起こす.水道水質基準1 mg L-1 以下,水質汚濁法排水基準2 mg L-1 以下.[CAS 7440-66-6]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「亜鉛」の意味・わかりやすい解説
亜鉛【あえん】
→関連項目非鉄金属
出典 株式会社平凡社百科事典マイペディアについて 情報
食の医学館 「亜鉛」の解説
あえん【亜鉛】
最近、若い人たちの亜鉛(あえん)不足が指摘されています。ファーストフードにかたよった食事や極端なダイエットを続けると、とくに亜鉛不足をまねきやすいので注意しましょう。
亜鉛はワタリガニやカキなどに多く含まれており、成人1日の推奨量は男性9~10mg、女性7~8mgです。
漢方薬・生薬・栄養成分がわかる事典 「亜鉛」の解説
あえん【亜鉛】
ブリタニカ国際大百科事典 小項目事典 「亜鉛」の意味・わかりやすい解説
亜鉛
あえん
zinc
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「亜鉛」の解説
亜鉛
毛髪用語集 「亜鉛」の解説
亜鉛
出典 抜け毛・薄毛対策サイト「ふさふさネット」毛髪用語集について 情報
世界大百科事典(旧版)内の亜鉛の言及
【非鉄金属工業】より
…非鉄金属とは広義には鉄以外の金属の総称であるが,一般的には銅,鉛,亜鉛,スズ,タングステンなどの金属を指し,アルミニウムやマグネシウムなどは軽金属,金,銀,白金などは貴金属として区別することが多い。なかでも銅,鉛,亜鉛は各種の基礎資材として大量に使用され,資源も豊富なため,ベースメタルと呼ばれる。…
※「亜鉛」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...