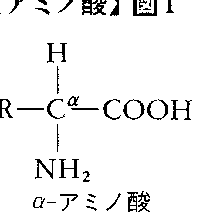翻訳|amino acid
精選版 日本国語大辞典 「アミノ酸」の意味・読み・例文・類語
アミノ‐さん【アミノ酸】
改訂新版 世界大百科事典 「アミノ酸」の意味・わかりやすい解説
アミノ酸 (アミノさん)
amino acid
化学調味料のグルタミン酸,栄養剤飲料中のアルギニンやアスパラギンなど,学校給食に添加するしないで話題になったリシン,これらはみなアミノ酸である。このようにアミノ酸が食品成分として重要視されるのは,まず何よりも生物が生きていくうえで不可欠なタンパク質がアミノ酸からできているからである。食物中のタンパク質は,消化酵素によってアミノ酸にまで分解された後,体内に吸収される。吸収されたアミノ酸は,さらに分解されてエネルギー源となるか,あるいは遺伝情報に従ってつなぎ合わされ,種々のタンパク質となる。新しくできたタンパク質は生物体の構成成分や酵素として重要な機能を担うことになる。
アミノ酸の構造と性質
化学的には,1分子中にカルボキシル基-COOHとアミノ基-NH2の両方をもつ有機化合物を総称してアミノ酸という。またこの定義を少し広げて,アミノ基の代りに修飾されたアミノ基やイミノ基-NH-をもつもの,カルボキシル基の代りにスルホ基-SO3Hをもつものもアミノ酸に含めることが多い。種々のアミノ酸のうちで,カルボキシル基の結合している炭素原子(α-炭素という)にアミノ基の結合しているものをα-アミノ酸,その隣の炭素原子にアミノ基の結合しているものをβ-アミノ酸,以下,離れるにつれγ-,δ-,ε-アミノ酸などという(図1)。アミノ酸はカルボキシル基が酸,アミノ基が塩基の性質を示すので,両性電解質といわれる。水溶液中で中性のpHでは,カルボキシル基とアミノ基は水素イオンをそれぞれ解離・結合して,-COO⁻,-NH3⁺という電荷をもつ形をとる。これらの電荷が存在するため,アミノ酸の結晶は融点が高く(多くは200℃以上で,溶ける前に分解),水に溶かすと誘電率を増加させる。
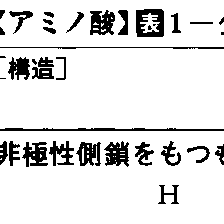
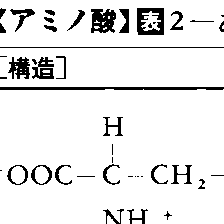
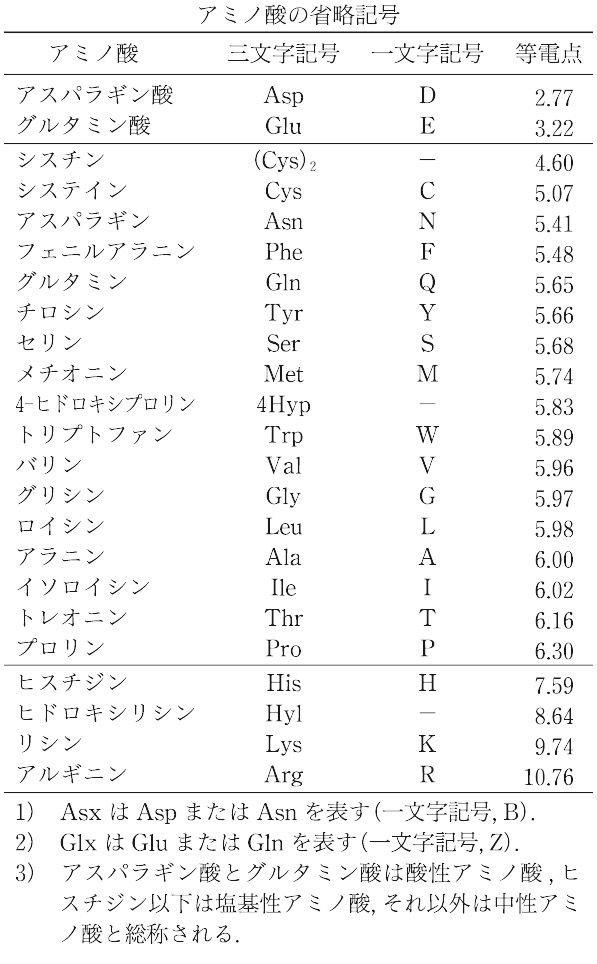
19世紀初めから現在に至るまでに,生物から数百種類のアミノ酸が発見されており,動植物やその成分にちなむ名前をつけられたものも多い。たとえば,アスパラギンの名はアスパラガスに由来するし,グルタミン酸は小麦のタンパク質であるグルテンにちなむ。このうちでタンパク質を構成するアミノ酸は,基本的には20種類であり,しばしば3文字または1文字の略号で表記される(表1)。またこの20種のアミノ酸はみなα-アミノ酸で,α-炭素原子には,カルボキシル基,アミノ基,水素原子,および各アミノ酸に固有の基(側鎖と呼ばれる)の四つが結合している。この場合,側鎖が水素原子であるグリシンを除き,α-炭素原子が不斉炭素原子であるため図2のような二つの立体(光学)異性体,D-型とL-型が存在するが,タンパク質を構成するアミノ酸はみなL-型である(立体特異性があるという)。これは,化学合成でできるアミノ酸がD-型とL-型の混合物(ラセミ体)であるのと異なり,生体内で起こる反応のいちじるしい特徴の一つである。D-型アミノ酸は生体内では珍しいが,細菌の細胞壁やある種の抗生物質などには含まれる。なお,タンパク質中に上記20種以外のアミノ酸が含まれることがあるが,これは20種のアミノ酸のどれかがタンパク質合成後に修飾を受けて変化したものである(表2)。
タンパク質はアミノ酸が数十個から数千個,結合してできる。
⁺H3N・CHR1・COO⁻+⁺H3N・CHR2・COO⁻+……+⁺H3N・CHRn・COO⁻─→⁺H3N・CHR1・CONH・CHR2・CONH……CONH・CHRn・COO⁻+(n-1)H2O
ここでタンパク質中のアミノ酸の単位-NH・CHRi・CO-をアミノ酸残基,つなぎ目の部分-CONH-をペプチド結合という。またタンパク質内でのアミノ酸残基の順序をアミノ酸配列,順序を問わない各アミノ酸の量をアミノ酸組成という。アミノ酸組成を調べるには,タンパク質を6規定塩酸中,110℃で一昼夜,加水分解し,アミノ酸に変えてから自動アミノ酸分析機にかけて各アミノ酸を定量する。定量法としては,ニンヒドリンを加えて加熱し,できた青色(プロリンの場合は黄色)の化合物を比色定量することが多い。アミノ酸配列はタンパク質を酵素や化学反応で断片化したり,末端のアミノ酸を遊離させたりした後,アミノ酸組成を調べるという操作をくり返して決定する。アミノ酸配列はアミノ末端側からカルボキシル末端側への向きで(前記の化学式の左から右へ),たとえばMet・Leu・Arg・……・His・Serなどと表記する。生体内でのタンパク質合成の際には,アミノ酸配列はメッセンジャーRNA(mRNA)上での塩基の三つ組(トリプレットまたはコドンという)の配列により決定される。トリプレットとアミノ酸との対応を示す表は遺伝暗号表(遺伝暗号)またはアミノ酸コード表と呼ばれる(表1)。トリプレットの2番目の塩基が,対応するアミノ酸の物理・化学的性質と相関関係がある(2番目にUをもつものは非極性アミノ酸。A,Gをもつものは側鎖に電荷をもつアミノ酸)。
アミノ酸の種々の側鎖の物理・化学的性質は,タンパク質の構造形成と機能にうまく使われている。たとえばLeu,Pheなどの非極性側鎖は水と親和性が低く,Arg,Glnなどの極性側鎖は水と親和性が高い。タンパク質分子は固有の立体構造をとる際に,なるべく非極性側鎖が分子内部に,極性側鎖が分子表面に位置して折りたたまれるように設計されている。またCys,His,Ser,Asp,Gln,Lysの側鎖は他の有機化合物と求核反応する性質をもっているが,多くの酵素ではこれらのアミノ酸残基が活性中心にあって,化学反応をつかさどっている。またあるpHで電解性側鎖に水素イオンの結合・解離が起こるとタンパク質の性質が変わり,これが生理活性のpHによる調節機構の基盤となっていることが多い。
アミノ酸の分解と合成
アミノ酸R・CHNH3⁺・COO⁻は生体内で分解される際,はじめにいくつかの反応で酸化され,対応するケト酸R・CO・COOHとアンモニアNH3になる。アンモニアは植物や微生物では生合成に再利用されることが多いが,動物ではかなりの部分が排出される。一般に水生動物ではアンモニアのまま,陸生脊椎動物では尿素や尿酸に変えられてから排出される。一方,ケト酸の方はピルビン酸,アセチルCoA,クエン酸回路中間体のいずれかを経てクエン酸回路に入り,二酸化炭素にまで分解される(図3)。この時,哺乳類ではアセチルCoAになるアミノ酸(Leuなど)は,クエン酸回路中間体が存在しないとクエン酸回路に入れず,副反応でアセトンなどのケトン体を蓄積する。これに対しピルビン酸やクエン酸回路中間体になるアミノ酸(Ala,Asp,Glnなど)は,それのみで完全に分解されるだけでなく,オキサロ酢酸を経てブドウ糖になることもできる(図3)。
アミノ酸を生合成する能力は生物種によって異なる。ヒトはタンパク質を構成するアミノ酸20種のうち10種(Arg,Ile,Trp,Thr,Val,His,Phe,Met,Lys,Leu)を十分量合成できず,食物として摂取しなければならない。これを必須アミノ酸(不可欠アミノ酸)という。高等植物は20種のアミノ酸全部を合成でき,微生物は種により合成能力がまちまちである。いずれの場合でもアミノ酸は,炭水化物代謝すなわち解糖系,ペントース・リン酸経路,クエン酸回路の中間体より合成される(図4)。このときの窒素源は直接的にはアンモニアであるが,植物や一部の微生物では硝酸塩を,根粒バクテリアなどでは窒素ガスをアンモニアに変えることができるので,これらの反応も生態系的観点から重要である。またアミノ酸を材料(の一部)として生合成されるものに,タンパク質のほか核酸の塩基,ヘムなどがある。
実験室でのアミノ酸の化学合成法としては,シュトレッカーStrecker法が有名である。これはアルデヒドにシアン化水素とアンモニアを作用させた後,加水分解する方法である。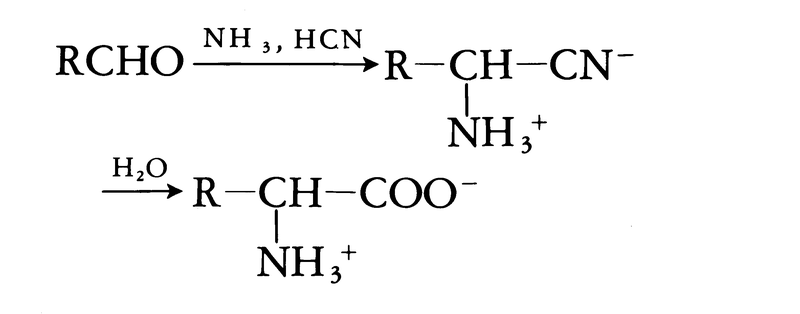
またカルボン酸のα-炭素をクロロ化またはブロモ化した後に大過剰のアンモニアを加えてアミノ基に置き換えるのも簡単で便利な方法である。
工業的な面から見ると,種々のアミノ酸のうちで,L-グルタミン酸(化学調味料。1979年の世界供給量約27万t),D,L-メチオニン(飼料添加物。同約18万t),L-リシン(飼料添加物。同約2万5000t),グリシン(食品添加物。同約6000t)が主な生産品である。他のアミノ酸は医薬品としての需要が主だが,おのおの年間数百t以下の生産しかない。これらは微生物による発酵法(グルタミン酸,リシンなど),化学合成法(メチオニン,グリシンなど),この両者の組合せ(アスパラギン酸,アラニンなど),タンパク質分解物よりの抽出(チロシン,シスチンなど)などの方法により作られている。今後は遺伝子工学の発展により,発酵法が盛んになると思われる。
アミノ酸と化学進化
アミノ酸は生物を構成する基本的物質であるから,隕石の中にアミノ酸が見つかると宇宙生命の痕跡を示すものとして話題になる。1953年にミラーS.L.Millerはメタン,アンモニア,水素,水蒸気の混合気体中で放電を行ったところ,グリシン,アラニンなどのアミノ酸が得られたと発表した。これは,太古の地球上の原始気体から無機的にアミノ酸が生じえたという可能性を示すもので,生命発生の前段階の化学進化のモデルとして有名である。
→RNA →タンパク質
執筆者:桂 勲
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「アミノ酸」の意味・わかりやすい解説
アミノ酸
あみのさん
1分子内にアミノ基とカルボキシ基(カルボキシル基)をもつ有機化合物の総称。タンパク質を塩酸などで完全に加水分解して得られるものは、アンモニアと遊離アミノ酸であり、アミノ酸はすべての生命現象をつかさどっているタンパク質の基本構成単位である。タンパク質から分離されたアミノ酸はほとんどが、アミノ基とカルボキシ基とが同じ炭素原子に結合し、一般式R-CHNH2-COOHで示されるα(アルファ)-アミノ酸である。Rは脂肪族、芳香族、複素環式の置換基を示す。このほか、アミノ基が順次、隣の炭素原子に移るにつれてβ(ベータ)-アミノ酸、γ(ガンマ)-アミノ酸、δ(デルタ)-アミノ酸などと名づけられている。一般にアミノ酸といえばα-アミノ酸をさす。
最初に発見されたアミノ酸はアスパラギンで、1806年にフランスの化学者ボークランとロビケがアスパラガスの芽から新しい結晶を分離し、これをアスパラギンと命名した。タンパク質の加水分解物から初めてアミノ酸を分離したのはフランスの化学者ブラコノーH. Braconnot(1780―1855)で、1820年に膠(にかわ)、肉、羊毛などを硫酸で分解して膠からはグリシンを、肉や羊毛からはロイシンを単離した。以後1936年アメリカの生化学者マイヤーとローズW. C. Rose(1887―1985)によるトレオニンの発見に至る約130年間にわたって、22種の主要アミノ酸が発見されている。このほかに、自然界からは動植物、微生物のペプチドや特殊なタンパク質の構成成分として、あるいは遊離アミノ酸として、いろいろなアミノ酸が発見されていて、その数は約360種以上に達している。
[岡崎英雄]
種類と性質
アミノ酸はグリシンを除き一般に光学異性体をもっているが、タンパク質中のすべてのアミノ酸は、α‐炭素に関するカルボキシ基とアミノ基との配置の関係が同一で、L型である。しかし、D-アミノ酸もまた天然に存在し、ある種の微生物の細胞壁に多く含まれる。D-アミノ酸を含んだペプチドは強い抗菌作用または毒性を示すものが多く、グラミシジンやバシトラミンのようなポリペプチド性抗生物質はその一例である。
タンパク質を構成する主要アミノ酸は、脂肪族アミノ酸、芳香族アミノ酸、複素環式アミノ酸に大別される。脂肪族アミノ酸のうち、モノアミノモノカルボン酸としてグリシン、アラニン、バリン、ロイシン、イソロイシンがあり、ヒドロキシモノアミノモノカルボン酸としてはセリン、トレオニンがあり、モノアミノジカルボン酸およびアミドとしてはアスパラギン酸、グルタミン酸、アスパラギン、グルタミンがあり、さらにジアミノモノカルボン酸としてリジン、ヒドロキシリジン、アルギニンがあり、硫黄(いおう)含有アミノ酸としてはシステイン、シスチン、メチオニンがある。芳香族アミノ酸としてはフェニルアラニンやチロシンがあり、また複素環式アミノ酸としてはトリプトファン、ヒスチジン、プロリン、ヒドロキシプロリンなどがある。
これ以外にも自然界に存在する比較的重要なアミノ酸として、β-アラニン、γ-アミノ酪酸、オルニチン、シトルリン、ホモセリン、トリヨードチロシン、チロキシン、ジオキシフェニルアラニンがある。
約20種の主要アミノ酸のうち体内で合成できなくて食物からとらなければならない必須(ひっす)アミノ酸は、成人の場合はバリン、ロイシン、イソロイシン、メチオニン、トレオニン、リジン、フェニルアラニン、トリプトファンであり、幼児ではさらにヒスチジンが必須で、その他は非必須アミノ酸である。非必須アミノ酸はトランスアミナーゼにより、体内で必須アミノ酸から合成できるが、グルタミン、アスパラギン、アラニン、プロリンなどの非必須アミノ酸では、はるかに容易にトランスアミネーション(アミノ基の転移反応)がおこって他の非必須アミノ酸を合成する。
一般にアミノ酸は白色結晶で、比較的安定な物質で高い融点をもつが、分解を伴って明確な融点を示しにくい。分子量はグリシンの75からトリプトファンの204まであり、平均分子量は142である。水に対する溶解性はシスチンとチロシンが難溶で、アスパラギン酸、グルタミン酸はやや難溶であるほか、一般に溶けやすい。ただし、アスパラギン酸とグルタミン酸はともにその塩酸塩では溶けやすい。アミノ酸は両性イオンであり、アルカリの添加によって水素イオンを失い、酸の添加によって水素イオンをとらえる。そのために、アミノ酸の水溶液はpHの変化に抵抗する緩衝作用をもち、固有の等電点をもっている。アスパラギン酸、グルタミン酸の等電点は約3で、アルギニン、リジン、ヒドロキシリジンは9から10で、他のアミノ酸では約6である。
アミノ酸は、カルボキシ基とアミノ基に特有なすべての反応のほかに、それぞれの分子内にある反応基に特有な反応を示す。アミノ酸の検出確認にも応用されるニンヒドリン反応は前者のもっとも重要な呈色反応であり、黄色を示すものもあるが、普通は青紫色を呈する。また、後者の特定のアミノ酸の呈色反応で分析手段として一般に用いられているものに、ミロン反応(チロシン)、坂口反応(アルギニン)、ニトロプルシド試験(システイン)、エールリヒ反応(トリプトファン)、パウリ反応(ヒスチジン、チロシン)がある。
アミノ酸の一般的反応としては、亜硝酸、ニンヒドリン、過酸化水素、グリセリンと作用し、それぞれオキシ酸、アルデヒド、ケト酸、アミンを生じる。また、アミノ酸は還元剤の作用を受けにくいが、そのエステルはナトリウムアマルガムや水素で容易に還元され、相当するアルデヒドやアルコールになる。
アミノ酸の分析定量法は、ニンヒドリン反応とイオン交換クロマトグラフィーの原理を応用したやや古典的な方法のほか、最近では蛍光ラベル法と高速液体クロマトグラフィー法の組合せにより、ピコモル(10-12mol)オーダーの微量分析が可能になり、臨床診断に広く利用されるようになってきた。アミノ酸の尿あるいは血液中における著しい増減は、しばしば脳の発育異常を伴うものが多く、40にも達するアミノ酸代謝異常症が報告されている。
[岡崎英雄]
製法
天然のタンパク質を加水分解する方法のほか、化学合成法、発酵法、酵素法が現在用いられている。アミノ酸は、最近ではビタミンと並んで広く栄養剤、調味料、動物の飼料強化などに需要が著しく、とくに日本においては欧米に先んじてアミノ酸の製造工業が独特の発展を遂げた。1908年(明治41)池田菊苗(きくなえ)がコンブのうま味の成分がグルタミン酸によることを発見、当初はグルテンあるいは大豆タンパク質の加水分解によってつくられたが、1957年(昭和32)木下祝郎らによってブドウ糖から直接にL-グルタミン酸を多量に生成する微生物が発表されて以来、グルタミン酸以外のいろいろなアミノ酸も、発酵法により生産されるに至った。この加水分解と発酵によって得られるアミノ酸はすべてL-アミノ酸だけであるが、合成法によって得られるアミノ酸はD-、L-アミノ酸の混合物で、光学分割法やラセミ化などの研究が積極的に推進された。つまり酵素法というのが、このラセミ化を微生物酵素(ラセマーゼ)によって行い、L-アミノ酸を大量にできるようにしたものである。
現在では、一部の特別なアミノ酸を除いてはすべて化学合成法、発酵法、酵素法で工業的につくられている。2005年(平成17)の世界におけるグルタミン酸ソーダの生産能力は167万トンで、うち日本の生産能力は約3万トンにすぎず、おもにベトナム、インドネシア、韓国、台湾などから計7万7000トンを輸入している。
[岡崎英雄]
人体との関係
食品タンパク質から得られるアミノ酸は約20種類あるが、カルボキシ基の隣の炭素にアミノ基がついたα-アミノ酸である。アミノ酸には光学異性体のD型とL型があるが、天然のアミノ酸はL型である。タンパク質は消化管内でペプシン、トリプシン、キモトリプシンなどの消化酵素により、アミノ酸に分解される。大部分はアミノ酸の形で吸収されるが、ごく一部は小さいペプチドのまま吸収される。腸管から吸収されたアミノ酸は門脈を通って肝臓に入り、そこで血漿(けっしょう)タンパク質に合成される。一部のアミノ酸はそのまま血液に入り、血漿タンパク質とともに組織タンパク質の給源となる。食物から供給されたアミノ酸と体の組織から供給される遊離アミノ酸は、入り混じってアミノ酸プールを形成し、体タンパク質の合成と分解を繰り返して、つねに体の機能を更新している。アミノ酸を材料にして体タンパク質が合成されるが、この際にとくに重要なアミノ酸を必須(ひっす)アミノ酸とよんでいる。前述のように必須アミノ酸は成人で8種類、幼児で9種類のアミノ酸をさしている。これらのアミノ酸はその割合がたいせつで、栄養上ふさわしい割合に供給されることが望ましく、その必要量が示されている。この必須アミノ酸の割合をアミノ酸バランスとよんでいる。食品タンパク質とくに植物性タンパク質には、必須アミノ酸の不足するものがあり、リジン、メチオニン、トリプトファンなどを加えると栄養価が向上する。これをアミノ酸補足効果とよんでいる。
アミノ酸は合成法、発酵法などによって工業的に生産され、家畜の飼料に添加して栄養価を高めることが行われている。パンにリジンを強化することも有効である。食品加工においては味をよくすること、香りをよくすることにアミノ酸が応用されている。
[宮崎基嘉]
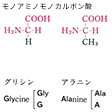
タンパク質構成主要アミノ酸の構造と略号…
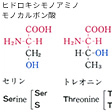
タンパク質構成主要アミノ酸の構造と略号…
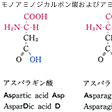
タンパク質構成主要アミノ酸の構造と略号…
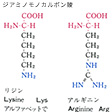
タンパク質構成主要アミノ酸の構造と略号…
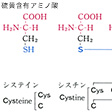
タンパク質構成主要アミノ酸の構造と略号…
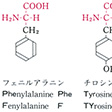
タンパク質構成主要アミノ酸の構造と略号…
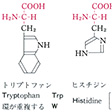
タンパク質構成主要アミノ酸の構造と略号…
化学辞典 第2版 「アミノ酸」の解説
アミノ酸
アミノサン
amino acid
分子内にアミノ基(置換アミノ基も含む)とカルボキシル基をもつ化合物の総称.アミノ基とカルボキシル基が同一炭素原子に結合しているものをα-アミノ酸,相対結合位置が離れるに従い,β-,γ-,δ-アミノ酸と称する.もっとも重要なものはα-アミノ酸で,タンパク質を構成しているアミノ酸はすべてα-アミノ酸RCH(NH2)COOH(RはHまたは炭化水素基)である.分子中に含まれるアミノ基とカルボキシル基の数の割合によって等電点が異なり,中性(モノアミノモノカルボン酸),酸性(モノアミノジカルボン酸),塩基性(ジアミノモノカルボン酸)アミノ酸に分類される.また,Rの種類により,脂肪族あるいは芳香族アミノ酸,硫黄を含むものを含硫アミノ酸,ヒドロキシ基をもつものをヒドロキシアミノ酸ということもある.通常,タンパク質からは20種類のアミノ酸が単離確認されている.自然界には,さらに約200種類が遊離アミノ酸またはペプチドとして存在することが報告されている.タンパク質を加水分解したアミノ酸混合物からの分離には,等電点沈殿,電解,イオン交換クロマトグラフィー,吸着剤による方法,溶媒による抽出,エステル化後分留などの方法があり,特定のアミノ酸に対しては適当な化合物と難溶性塩として分離する.工業的には,微生物の培地に特定のアミノ酸を蓄積させる発酵法も用いられる.ハロカルボン酸とアンモニアとの置換反応がもっとも一般的なアミノ酸の合成法であるが,α-アミノ酸の合成法のおもなものには,ストレッカー法(ストレッカーのアミノ酸合成),α-(アシルアミノ)マロン酸法,α-ケト酸の還元アミノ化法などがある.D,L-アミノ酸はN-アシル化後,光学活性塩基やアシラーゼによる不斉加水分解によって光学分割される.天然産のアミノ酸はL形であるが,ペプチド抗菌性物質はD形を含むことがある.一般に結晶しやすく味があり,無機塩に似た性質をもつ.すなわち,融点は高く分解点を示すものが多く,水に可溶,有機溶媒に不溶である.分子内にアミノ基とカルボキシル基をもつので両性電解質であり,酸性溶液中では陰極へ,アルカリ性溶液中では陽極へ泳動する.酸塩基平衡は次式のとおりである.
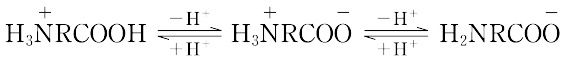
等電点では,個々のアミノ酸は溶解度が最小,旋光度は最低値を示す.化学的には,アミンとカルボン酸の両方の反応性を示す.また,ヒダントイン,カルバミド酸,アズラクトン,ジケトピペラジン,ペプチドなどを形成する.α-アミノ酸はニンヒドリンと反応して青紫色ないし赤紫色に呈色するので,定性や定量に用いられる.栄養上あるいは窒素平衡を保つのに外部から摂取する必要のあるアミノ酸は必須アミノ酸とよばれる.特有の生理活性をもつものも多く,医薬や調味料に使われる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「アミノ酸」の意味・わかりやすい解説
アミノ酸
アミノさん
amino acid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「アミノ酸」の意味・わかりやすい解説
アミノ酸【アミノさん】
→関連項目トランスアミナーゼ
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「アミノ酸」の解説
アミノ酸
世界大百科事典(旧版)内のアミノ酸の言及
【栄養】より
…このような栄養型を独立栄養(無機栄養,自栄養)という。これに対して動物の多くはきわめて限られた合成能力しかもたず,エネルギー源として炭水化物,脂肪,タンパク質などの高分子化合物を必要とするうえに,体を構成するタンパク質の材料である20余種のアミノ酸のうちの約10種(必須アミノ酸),補酵素などの構成成分として必要なビタミン類,不飽和脂肪酸なども要求し,それらのものを食物として摂食する必要がある。このような栄養型を従属栄養(有機栄養,異栄養)という。…
【化学化石】より
…1967年,G.エグリントンとM.カルビンが命名した。化石の有機物については,すでに1954年にP.H.アーベルソンによって,デボン紀以降の各種の化石からアミノ酸が検出され,化石の研究に生化学の方法が導入できるとして,古生化学という研究分野が提唱されていた。最も安定な有機化合物は炭化水素で,炭素‐炭素の結合エネルギーは66.5kcalである。…
【カルボン酸】より
…分子内に環式構造をもたない鎖式のモノカルボン酸を脂肪酸という。カルボキシル基以外に水酸基-OH,アミノ基-NH2,カルボニル基![]() C=O等をもつものをそれぞれヒドロキシ酸(オキシカルボン酸,オキシ酸ともいう),アミノ酸,ケト酸などと呼ぶ。カルボン酸のなかには古くから知られているものが多いために,ギ(蟻)酸,酢酸,安息香酸と慣用名で呼ばれるものが多いが,複雑なものについては組織的命名法である国際命名法(IUPAC命名法)が用いられている。…
C=O等をもつものをそれぞれヒドロキシ酸(オキシカルボン酸,オキシ酸ともいう),アミノ酸,ケト酸などと呼ぶ。カルボン酸のなかには古くから知られているものが多いために,ギ(蟻)酸,酢酸,安息香酸と慣用名で呼ばれるものが多いが,複雑なものについては組織的命名法である国際命名法(IUPAC命名法)が用いられている。…
【タンパク質(蛋白質)】より
…しかし,われわれが牛肉を食べても,牛肉のタンパク質がそのまま体内に入り,筋肉になるのではない。牛肉のタンパク質は,消化管内で構成成分であるアミノ酸にまで分解された後,体内に吸収される。生物の体は,これらのアミノ酸を遺伝情報(核酸の塩基配列)に従ってつなぎ,それぞれに固有のタンパク質を合成するのである。…
※「アミノ酸」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
[名](スル)二つ以上のものが並び立つこと。「立候補者が―する」「―政権」[類語]両立・併存・同居・共存・並立・鼎立ていりつ...