デジタル大辞泉 「酸」の意味・読み・例文・類語
さん【酸】
2 水溶液中で水素イオンを放出する物質。放出が強いものを強酸、弱いものを弱酸という。塩基と反応して
[類語]硫酸・亜硫酸・塩酸・硝酸・硼酸・酒石酸・燐酸・酢酸・炭酸・
翻訳|acid
化学的性質に従って物質を分類するとき、相反する性質をもつ塩基とともに対照的に、そして相補的に定義される物質。塩基の性質を打ち消す性質をもつ物質が酸であり、逆に、酸の性質を打ち消す性質をもつ物質が塩基である。
[岩本振武]
酸は、洋の東西を問わず、食酢や果汁のような酸性物質の示す味覚から「酸」とよばれるようになった(ラテン語の酸っぱいを意味するacidusに由来する、英語のacidを導入したのは1626年、F・ベーコンである)。食酢、果汁などの植物起源の物質に含まれる有機酸のほかにも、硫酸、硝酸、塩酸などの鉱物起源の無機酸(鉱酸)があり、これらの酸が木灰などのアルカリ(塩基)の性質を中和することは、錬金術の時代までにすでに知られていた。リトマス紙が酸によって赤色に、アルカリによって青色になる事実は17世紀に知られた。リトマス紙とは、地中海産のコケから抽出される色素をしみ込ませた紙である。
硫酸、硝酸、カルボン酸などの酸には、共通して酸素が含まれることから、酸性は酸素の存在に基づくと考えられた時期もあり、18世紀の末にフランスのA・L・ラボアジエは、スウェーデンのK・W・シェーレとイギリスのJ・プリーストリーの発見した気体に「酸素」oxygène(フランス語)と命名したが、これは文字どおり、酸素を「酸の素(もと)」と考えたからである。しかし19世紀になると、塩酸HCl、ヨウ化水素酸HI、青酸HCN(シアン化水素酸)などの、酸素は含まないが、水素を共通に含む酸の存在が明らかになり、酸には「酸素酸」と「水素酸」の2種類があるとされたこともあった。電離説に基づいて、酸・塩基の統一的定義をスウェーデンのS・A・アレニウスが提出したのは1884年のことである。
[岩本振武]
アレニウスによれば、酸とは水に溶けて電離することにより、水素イオンH+を放出する物質であり、塩基とは同様の過程により、水酸化物イオンOH-を放出する物質である。酸HAあるいは塩基BOHは水溶液中での(1)あるいは(2)の解離平衡にあり、(4)、(5)で与えられる解離定数の大小によって酸・塩基の強弱が比較できる。また、酸と塩基との中和反応(4)によって、塩BAと水を生ずる。
アレニウスの定義は、水溶液系での酸・塩基の挙動を明快に説明したが、水以外の溶媒(非水溶媒)ではかならずしも成立せず、また、それ自身には解離する水素あるいはヒドロキシ基をもたない物質には適用できない欠点があることもわかった。たとえば、酸には例が少ないが、アンモニアやピリジンなどの塩基は、OHを含んではいないけれども、それらの水溶液は塩基性である。
[岩本振武]
1923年にデンマークのJ・N・ブレンステッドによって提出された酸・塩基の理論は、これらの欠点を克服するものであった。彼の理論によると、酸と塩基は水素イオンを介した共役関係にある。酸は水その他の溶媒に溶けて水素イオンを放出する物質であり、その限りではアレニウスの定義とほとんど変わりない。しかし、水素イオンを放出したあとに残る、酸根に相当する物質は、その酸と共役関係にある塩基である、とするのである。
この考えによると、酸あるいは塩基とされる物質が溶媒に溶ける反応自体が、すでに一つの酸・塩基反応となる。そして溶媒は、酸に対しては塩基、塩基に対しては酸として作用する両性物質になる。の(1)の酸HAが水に溶ける反応では、HAはH+を放出して共役塩基A-になるが、H+は塩基として作用するH2Oに受け取られてH3O+となる。H3O+とH2Oとは、互いに共役する酸・塩基の組合せとなる。の(2)の塩基Bが水に溶ける反応では、HB+とB、およびH2OとOH-がそれぞれ互いに共役する酸・塩基の組合せとなる。溶媒の自己酸・塩基解離平衡も、一方が酸、一方が塩基となる溶媒分子間の反応で、互いに共役する塩基と酸になるとみることができる。このように、ブレンステッドの定義によると、酸・塩基の反応は、かならず2組の共役酸・塩基反応の組合せとなる。これらの関係を整理すると、結局のところ、水素イオンを放出する物質が酸であり、受け取る物質が塩基である。
[岩本振武]
ブレンステッドの定義は、水素イオンを解離する溶媒(プロトン性溶媒)の系には成立するけれども、そのような水素をもたない非プロトン性の溶媒の中でも、形式的には酸・塩基反応と同じになる反応がある。このような系に対して、ブレンステッドの提案と同じ年の1923年、アメリカのG・N・ルイスは、さらに拡張された酸・塩基の定義を提出した。ルイスによれば、結合に関与する電子対を受け取る受容体(アクセプターacceptor)が酸であり、電子対を提供する供与体(ドナーdonor)が塩基である。この定義によると、アレニウスおよびブレンステッドの定義した酸・塩基も矛盾なく説明され、さらに配位錯体の生成反応も酸・塩基の反応として説明される。
[岩本振武]
ルイスの定義による酸・塩基は、ルイス酸、ルイス塩基とよばれることが多い()。配位錯体の生成は、ルイス酸に対するルイス塩基の配位である。配位錯体の安定性や反応性は、受容体原子と供与体原子との組合せによって支配されることが多い。一般にイオン半径または原子半径が小さくて電荷密度の高い受容体を硬い酸、同じく供与体を硬い塩基、逆にイオン半径または原子半径が大きくて電荷密度の低い受容体および供与体を軟らかい酸および軟らかい塩基という。硬いものどうしの結合はイオン性が強く、軟らかいものどうしの結合は共有性が強い。これをHSAB則hard and soft acids and bases principleという。硬いものどうし、軟らかいものどうしの組合せは、一般に安定な配位錯体を与える。
[岩本振武]
『田中元治著『酸と塩基』(1971・裳華房)』▽『水町邦彦著『酸と塩基』(2003・裳華房)』▽『山崎昶著『酸と塩基30講』(2014・朝倉書店)』


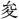 (しゆん)。〔説文〕十四下に「酢なり」とあり、五味の一。また酸苦・酸鼻のように惨苦の意に用いる。辛・甘を苦楽の意に用いるのと同じである。
(しゆん)。〔説文〕十四下に「酢なり」とあり、五味の一。また酸苦・酸鼻のように惨苦の意に用いる。辛・甘を苦楽の意に用いるのと同じである。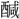 ▶・酸甘▶・酸感▶・酸箕▶・酸苦▶・酸
▶・酸甘▶・酸感▶・酸箕▶・酸苦▶・酸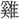 ▶・酸倹▶・酸梗▶・酸骨▶・酸恨▶・酸削▶・酸
▶・酸倹▶・酸梗▶・酸骨▶・酸恨▶・酸削▶・酸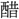 ▶・酸削▶・酸漿▶・酸杖▶・酸心▶・酸辛▶・酸呻▶・酸切▶・酸然▶・酸楚▶・酸棗▶・酸愴▶・酸丁▶・酸涕▶・酸甜▶・酸
▶・酸削▶・酸漿▶・酸杖▶・酸心▶・酸辛▶・酸呻▶・酸切▶・酸然▶・酸楚▶・酸棗▶・酸愴▶・酸丁▶・酸涕▶・酸甜▶・酸 ▶・酸毒▶・酸軟▶・酸敗▶・酸鼻▶・酸風▶・酸味▶・酸涙▶・酸冷▶
▶・酸毒▶・酸軟▶・酸敗▶・酸鼻▶・酸風▶・酸味▶・酸涙▶・酸冷▶ 酸・酒酸・硝酸・辛酸・青酸・凄酸・棗酸・炭酸・
酸・酒酸・硝酸・辛酸・青酸・凄酸・棗酸・炭酸・ 酸・乳酸・尿酸・梅酸・砒酸・悲酸・芳酸・
酸・乳酸・尿酸・梅酸・砒酸・悲酸・芳酸・ 酸・味酸
酸・味酸出典 平凡社「普及版 字通」普及版 字通について 情報
歴史的には,水溶液にしたとき,水素イオン H+(オキソニウムイオンH3O+)を陽イオンとして放出する物質で(アレニウス酸,[別用語参照]酸塩基の理論),その水溶液は酸味があり,酸塩基指示薬(リトマス,メチルオレンジなど)を酸性色にかえ,多くの金属に作用して水素を発生させるなどの共通な性質(いわゆる酸性反応)を示す.塩酸HCl,硝酸HNO3,硫酸H2SO4,リン酸H3PO4,シュウ酸H2C2O4などは代表的な酸である.現代では,酸の定義を拡張して,共役酸・塩基を考えて,プロトン(水素イオン,H+)をほかの物質に与えることのできる物質を酸と定める.
NH3 + H2O → NH4+ + OH-
の反応では,水が酸で,
HCl + H2O → H3O+ + Cl-
の反応では,塩化水素HClが酸である(ブレンステッド酸).さらに拡張して,電子対の授受を考え,電子対を受容することのできる物質を酸と定める.三酸化硫黄,五酸化二リンなどの非金属の酸化物(いわゆる酸性酸化物)を酸と考えることができる(ルイス酸).
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
出典 株式会社平凡社百科事典マイペディアについて 情報
→酸・塩基
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
…酸と塩基の概念には幾多の歴史的な変遷があるが,基本的には水溶液中で水素イオンを増大させるものが酸で,水素イオンを減少させるものが塩基である,とすることができる。現在の考え方からすれば,酸や塩基というべきものはかなりの数が古くから知られていたが,酸や塩基という語や概念がふつうに用いられるようになるのは17世紀ないし18世紀ころからである。…
※「酸」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...