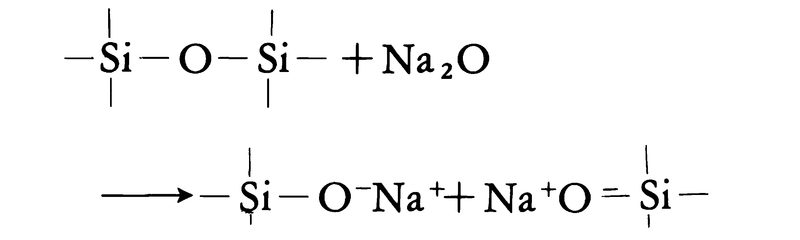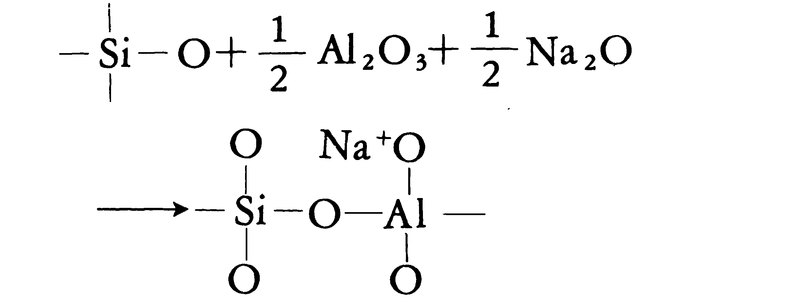日本大百科全書(ニッポニカ) 「ガラス」の意味・わかりやすい解説
ガラス
がらす
glass
もっとも簡潔な定義は「固体状態になった過冷却液体」で、同じく固体である結晶と対比される。アモルファスなど近縁の名称があるが、ガラス転移点Tg(ある狭い温度域を境として熱膨張係数などの温度係数や比熱が急激に変化する温度)が観測されるものだけに限定するのが妥当であろう。通常、「溶融法でつくられた無機酸化物(ケイ酸塩、ホウ酸塩、リン酸塩など)で、非晶質固体状態にあるもの」をガラスと称することが多いが、本来のガラスの定義は、製法や物質によって決まらない。したがって、気相法や液相法でつくられたガラス、あるいはプラスチックや金属でもガラスは存在する。
ガラスは透明で硬く、清潔な雰囲気のなかにいつまでも美しく輝き続けるという印象に加えて、一瞬にして砕け散ってしまうはかなさも備えている。5000年近く人類の文化とともに育ってきたガラスに対する人々のこのような印象は抜きがたい。しかし、いまやガラスは、防弾ガラス、プラスチックの定規のように曲がるガラス、電気を通すガラス、太平洋の底を横切ってアメリカと日本とを光通信で結ぶグラスファイバー(ガラス繊維)など、その発展に大きな飛躍がみられる。
[境野照雄・伊藤節郎]
歴史
地球上に初めて現れたガラスは自然がつくりだした黒曜(こくよう)石である。火山から噴出した溶岩が固まると結晶質の岩石になるが、急冷されるとガラス質になるものがある。鉄、マンガンなどを含んでいるから色は黒いが、光沢があり、割れやすく、薄い部分は光にかざすと深い紫色に見えたりする。のちに地上に出現した原始人は、鋭い破片を武器や工具に、形のよいものを装飾に使った。
ヨーロッパには紀元前1500年ごろのエジプト王朝時代のガラス器などが残っているが、人類がいつからガラスをつくり始めたかは正確には知られていない。しかしそれ以前から焼物のタイルがつくられていたから、その釉薬としてガラスに似た物質を扱っていて、それから発展したと考えられる。ガラスとそれをつくる技術は地中海沿岸からシルク・ロードおよび海路で中国に渡り、約2000年前に日本へ渡来したらしい。正倉院のカットガラス(白瑠璃碗(るりのわん))はその一例で、同型のものがシルク・ロードに沿って発見されている。エジプト王朝時代にはるつぼがなかったので、棒の端に砂と粘土の塊をつくり、その表面にすこしずつガラスを溶かして巻き付ける操作を繰り返して成形し、細工などを施してから冷ましたのち、砂や粘土をかき出してガラス器とした。溶融も不完全で、泡や不純物も多く、黄、緑、青、赤などの色模様は美しいが透明なものは少ない。やがて紀元前1世紀ごろに軟らかいガラスを鉄パイプの先に付け吹いて中空の器をつくる技術が現れた。また、ガラスを溶融するための耐火物ないしはるつぼの急速な発達もあって、ガラスは一挙に人間の生活に浸透していった。そして3世紀末には窓ガラスが現れている。寺院が色鮮やかなステンドグラスで飾られたことが9世紀末に記録されているが、現存する最古のものは12世紀のものである。他方、中国では紀元前数世紀にすでにガラス玉などの装飾品が現れている。
日本の弥生(やよい)、古墳時代の出土品にみられるガラスの勾玉(まがたま)や管玉(くだたま)などの多くは中国から渡来したものであるが、弥生中期には国内においてもつくられ始めている。しかしこれも平安時代には衰えて、長い空白ののち、16世紀ごろから、スペイン、ポルトガル、オランダなどからの鏡、望遠鏡、コップなどの流入が始まり、これらの刺激によって18世紀以降、大坂、江戸、ついで薩摩(さつま)などでふたたびガラスの生産が始まっている。
ヨーロッパでは12世紀ごろからベネチアのガラス工芸が急速に発展しベネチア・ガラスとして数百年にわたる隆盛のなかで、色彩豊かな種々の装飾的技法を生み出し、その影響は北欧からボヘミアまで、ヨーロッパ全域に及んだ。ヨーロッパと異なって、日本では平安時代以降の文化になじまなかったせいか、明治時代になるまで日常生活のなかにガラスが取り込まれることはほとんどなかった。
[境野照雄・伊藤節郎]
ガラスの一般的な特徴
多くのガラスには、(1)透明で等方性、(2)硬くもろい、(3)水に溶けず、変質しない、(4)耐熱性であるが温度の急変に弱い、(5)電気の絶縁体、(6)成形、加工しやすい、(7)組成の組合せの制約が少ない、などの性質があるから、窓ガラス、瓶、レンズ、ファイバー、蛍光灯、平面薄型テレビ、食器、鏡、コーヒーサイフォン、ビーズなど、さまざまな形となって、あらゆる方面で使われている。
このなかで特筆しなければならないのは(6)の性質で、板状、瓶状、菅状など、自由な形状をつくることができる。その秘密は、のように同じ固体でも結晶と異なり融点がないから、液体―過冷却液体―ガラスの間で、大部分の性質が温度変化に伴って滑らかに連続的に変わるからである。物質の流れにくさを測る粘性率(パスカル・秒、記号はPa・s)が、溶融温度の100Pa・sくらいから常温の1017Pa・sくらいまで変わるから、その中間領域でいろいろな成形が可能である。また(7)の性質のため、条件さえ適合すれば、ほとんどすべての元素をガラスとして取り込む特性があるので、原子炉の放射性廃棄物なども適当な化学組成に変えて安定なガラスにすることができる。
以上のように、ガラスはその歴史も古く、また日常生活はもとより科学、技術の方面まで広く利用されているにもかかわらず、その学問的な本質については不明な点も多く、興味ある物質といえる。
[境野照雄・伊藤節郎]
種類と性質
日常使われている主要なガラスの化学組成とその特性を、に示す。ただし、シリカガラス(石英ガラス)にはさらに純度の高いものがある。一般の傾向として二酸化ケイ素SiO2、酸化アルミニウムAl2O3の含有率の大きいものは使用温度限界が高くなるが、酸化ナトリウムNa2O、酸化ホウ素B2O3、酸化鉛PbOなどの多いものは逆に低くなる。ガラスの粘度が1012Pa・sになる温度(徐冷点)が高いほど使用温度限界も高い。温度の急変に対しては、熱膨張係数が低いガラスほど強い。一般のガラスが、温度が1℃上がると1000万分の1膨張する単位(10-7/℃)で90付近であるのに対して、フラスコやコーヒーサイフォンなどのガラスでは30近いものが多い。また、シリカガラス(石英ガラス)は5程度であり、さらにチタニア(二酸化チタンTiO2)を少量含むシリカガラスでは膨張係数がほぼゼロになるので、これらのガラスは灼熱(しゃくねつ)させた直後水中に投じても割れない。硬さは構成原子間の結合力や原子の充填(じゅうてん)率が高いものほど大きくなるが、機械的強度は人為的に発生した微小の傷その他の要因があって簡単には表されない。通常、ガラスは水や酸・アルカリに対する耐久性が高いが、薬品瓶やアンプルなどではわずかな溶解量が問題となるので、溶出量の少ないものが望まれる。一方、バイオ材料の分野では、溶解速度が制御され、適度に溶解しやすいガラスが求められている。
[境野照雄・伊藤節郎]
機械的強度
ガラスの破壊強度は、その硬さに比較すると異常に低いだけでなく、測定値のばらつきも大きい。に示す通常のガラスbでは1平方センチメートル当り100~3000キログラム、つまり30倍くらいの変動がみられる。1平方センチメートル当り700キログラム付近の印は通常のガラスの実用的強度である。しかし強化ガラスcやdのガラスはそれよりはるかに強く、シリカガラスの理論強度の1平方センチメートル当り24万キログラムに近いものもあり、をみても、直径5マイクロメートルのガラス繊維の強度はスチールよりずっと強い。ガラスの強度にこのような極端な開きが出るのは、(1)ガラスが硬くて変形しにくく、そのため、(2)表面に微小な傷が付きやすく、その傷によって強度が極度に低下するためである。この傷は深さ1~100マイクロメートルくらいのものが大半で、この程度の傷は指で軽くこすったりすると容易に発生する。のbはこのような傷を無数にもつ通常のガラスで、まったく傷がないと仮定した理論強度に比べ、強度は100分の1から1000分の1くらいに低下している。さらに、(1)表面の傷、(2)なまし不良などによる残留応力、(3)大気中の高い湿度が共存すると、ガラス製品が使用中または保存中に突然割れることがある。これは、湿気による傷の内面に対する侵食が、使用時にかかる引張り応力や残留している引張り応力によって加速されるためで、傷先端での応力集中が大きいほど侵食が進むという悪循環によって傷の先端がしだいに鋭くなり、応力集中が限界に達した時点で破壊する。この遅れ破壊あるいは疲労とよばれる現象は高温多湿の日本などでは注意する必要がある。
[境野照雄・伊藤節郎]
ガラスの構造
固体のもっとも安定な状態は原子または分子が規則的に整然と配列した結晶で、それがエネルギーのもっとも低い平衡状態にある。ガラスは配列の規則性が低く、エネルギーもやや高い非平衡状態にある。に、実用ガラスの主成分である二酸化ケイ素が単独で結晶(クリストバライト)になった場合と、ガラス(シリカガラス)になった場合の原子配列(構造)の相違を二次元的に図示した。両者とも共通の構造単位をもっているから、直径0.7ナノメートル程度の領域では両者間に差はみいだせないが、3ナノメートルほどの領域を比較すれば差がみられる。このことはガラス中に密度のゆらぎが生じていることを意味する。光ファイバーのように光路が長くなるとこの密度のゆらぎが光の散乱を起こし、光の伝送を妨げる要因となる。ただし、シリカガラスの構造図には異論もあるが、コンピュータのシミュレーションにより、その構造の詳細がさらに明らかにされつつある。以上は二酸化ケイ素単一成分系のガラスの構造であるが、酸化ナトリウム、酸化カルシウムなどを含む多成分系ガラスに関しては、その構造に対してさらに不確定な要素が増え、厳密に統一された結論はない。ただし、ナトリウムなどの陽イオンの存在点が古典的構造論の示すような無規則で均質なものではなくて、不均質な構造であると考えられている。コンピュータのシミュレーションによって、多成分系ガラスの構造も詳細に議論されている。
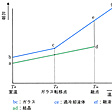
は、比容(物質1グラム当りの容積)の温度に対する変化から同一組成の結晶とガラスを対比したもので、融液を冷却する場合に、冷却速度が十分に遅いとf―e―d―aの経路をたどって比容aの結晶となるのに対して、冷却速度が速いとf―e―c―bと過冷却状態、転移点を経て比容bのガラスとなることを示している。室温でガラスの比容bが結晶の比容aより大きいことは、のような同一構成単位の規則的配列(1)と不規則な配列(2)とから容易に理解できよう。ただし、水と氷の関係のようにガラスのほうが結晶よりも比容が小さい場合もある。なお、ガラスと結晶とがガラス転移点以下でほぼ等しい熱膨張を示すのは、温度変化に対して原子配列がそれぞれ相似性を保っているからである。転移点以上の過冷却液体では構造の相似性は崩れ、たとえば温度上昇に伴ってc点のガラス構造からe点、f点の融液の構造へと結晶とは異なる構造変化を示している。厳密には冷却速度に従って転移点は温度軸上で左右に動き、その結果、b、cは上下に平行移動する。同一のガラスでも熱履歴によって密度、屈折率などに小差を示すのはこのためである。逆に、密度や屈折率を正確に決定するには、熱履歴(熱処理温度と時間、冷却速度など)を精密に制御する必要がある。
ある種の多成分系ガラスは高温では均質な融液となるにもかかわらず、温度が下がって粘度が増した段階で、組成の異なる2種の液相(液体)に分離する。この現象を分相といい、分離した相の大きさが数ナノメートルくらいでは肉眼的に検知できないが、可視光線の波長に近い大きさに達すると光の散乱によってタンパク光が現れる。たとえば二酸化ケイ素57.9%、酸化ホウ素31.6%、酸化ナトリウム10.5%付近の組成のガラスは、582℃付近では処理条件によって、分離した2相が互いに複雑に絡み合っている。量の多い相は高ケイ酸質、少ないほうの相は高ホウ酸ナトリウム質である。さらなる熱処理によって、それらの構造が大きくなるとガラスは光の散乱によって白濁してくる。この2相のうち、ホウ酸ナトリウムに富む相は水や酸によく溶ける。そこで、この分相したガラスを薄い塩酸に浸すと、片方の相が溶出して、残ったガラスには直径2~10ナノメートルほどの貫通孔が無数にでき、その孔の壁面の面積は1グラムのガラスについて200平方メートルにも達する。このような多孔性ガラスは吸着や、酵素固定用として広い用途をもっている。
[境野照雄・伊藤節郎]
ガラスの製造
どのような用途のガラスを大量に製造しているかによってガラス工業はのように分類できる。用途はきわめて多様で、それぞれ異なった要求に対応できるように、透明性、耐熱性、耐水性、機械的強さ、化学薬品に対する強さ、成形加工の容易さ、各種の色調などを制御する必要があり、さまざまなガラス組成が使われている。しかし、社会生活の変化にしたがって、ガラスに対する要求はつねに新たなものが現れるので、絶え間なく新しい化学組成のガラスをつくりだし、さらに生産性をあげ、省エネルギーを実現するため、物理蒸着、化学蒸着、ゾル‐ゲル法、直接通電式電気溶融、気中溶解など、新しい製造技術が生まれてきている。この項では、古くから行われている溶融法によるガラス製造について記す。
[境野照雄・伊藤節郎]
溶融
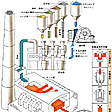
実用ガラスの主要原料は珪砂(けいさ)、珪石が主体で、以下のようにソーダ灰等、数種類を添加し、さらに目標とするガラスそのものや、それに類似したガラスのくず(カレット)を数十%加えたものを混合して原料とする。小規模では、100~200キログラム入りのるつぼで、大規模な連続溶解では、一端に原料の入口、他端に溶融ガラスの出口をもつ、容量10~1000トン程度の長方形のタンク炉を用い、1400~1600℃で溶解する。高温で溶解中に、あらかじめ原料に添加しておいた発泡剤が分解してガスを放出して大きな泡を発生し、同時にガラスの液体中に溶け込んでいる過飽和のガスや小さな泡をその泡中に取り込み成長しながら、浮上して、最終的に泡のない透明なガラスがつくられる。また、ガラス液体に接する雰囲気の酸化還元状態や水分がガラスの品質に大きな影響を与えるので、それらは厳密に制御されてつくられている。ガラス瓶の製造工程の例をに示す。
[境野照雄・伊藤節郎]
成形
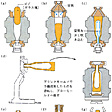
ガラスをるつぼで溶融する場合には、鉄竿(ざお)でガラスの適量を取り出し、空中で、または金型の中で吹いて成形する。前者を宙吹き法、後者を型吹き法という。溶けたガラスを型に流し込み機械でプレスして成形する場合もある。空になったるつぼには原料を入れ、繰り返し使用する。タンク炉の場合には一般に24時間当り数トンから1000トンのガラスを連続的に取り出し、数台の自動機械にかけて成形する。ソーダ石灰ガラス(ソーダライムガラス)に例をとれば、のように、1200℃から800℃まで冷却する間にガラスの粘性率は1000倍にも増大するから、製瓶の場合ほぼこの温度範囲を利用し、の(a)で金型に投入した軟らかいガラス塊が成形で急激に冷却され、数秒間で完成品(g)に達して取り出されるよう調節される。たとえば単純なコップ(タンブラー)は1台の機械で1日に約10万個つくられ、タンク炉は数年間、休むことなく運転される。蛍光灯のような管ガラスは、溶けたガラスを回転する円筒の周囲に巻き付けて融着させた後、円筒内部にガスを送りながら円筒周囲のガラスを引っ張ることによって管状に成形する。「板ガラス」「ガラス繊維」についてはそれぞれの項目を参照。
[境野照雄・伊藤節郎]
加工
冷却されたガラスは、種々の形状に切断加工される。切断には、通常ダイヤモンドカッターが用いられるが、2000年代に入り、レーザーによる切断加工技術が普及し始めている。自動車のように、曲面をもつガラスは、再度ガラスをガラス転移点以上の温度まで加熱し、型に合わせて加工する。また、加熱後冷たい風を吹き付けて、強化加工が行われる。携帯電話や携帯用ディスプレーなどのガラスは薄いため風冷による強化ができず、イオン交換による化学強化が行われる(強化ガラスの項参照)。
[境野照雄・伊藤節郎]
絵付け
コップ、瓶などには有機顔料、無機顔料、金属塩などでスクリーン印刷などを利用して模様をつけ、有機顔料以外は500℃以上で焼き付けるので、耐久性が高い。
[境野照雄]
コーティング
瓶の表面の摩擦を減らし、微細な傷に基づく強度劣化を防ぐ目的で塩化スズなどの溶液を成形後の瓶に噴霧し、なまし工程を利用して焼き付けたり、また炭酸飲料瓶の破片の飛散を防止する目的で、有機高分子材料の被膜をつけたりすることが行われている。また、光の反射による損失を防ぐため、フッ化マグネシウムその他の薄膜を真空蒸着などによってレンズ表面につけることも広く行われており、効率をあげるため多層膜としたものをスペクトラコーティングとよぶことがある。建築物や自動車の窓用ガラスには紫外線や赤外線の透過を制御したり、あるいは装飾したりするために、さまざまな材料がコーティングされている。これらの大部分はスパッタ法(加速したイオンをターゲットに衝突させて原子や分子を放出させることにより、基板上へ薄い膜を形成する方法)によってコーティングされている。また、光触媒をコーティングした防汚、防曇、撥水(はっすい)ガラスなども知られている。エレクトロニクス用や太陽電池用のガラス基板には透明電導膜がコーティングされている。
[境野照雄・伊藤節郎]
新しいガラス
古くはるつぼ溶融でつくられていたガラスも、特殊ガラスや光通信用グラスファイバーのような新しいガラスが開発されるたびに、新しい合成法が考え出されてきた。これらの非溶融法による方法のうち、ゾル‐ゲル法とよばれる金属アルコキシドを原料とする方法は、溶融法に比して処理温度が低いこと、るつぼからの不純物混入がないことなどにより、新しい性能をもったガラスの合成法、とくに薄膜ガラスの作製法として利用されている。原理は、1種または数種の金属アルコキシドのアルコール溶液を加水分解してゲルとし、加・減圧、加熱等の処理で遊離アルコールや過剰の水を抜いて、金属酸化物の均質混合体である透明なガラスとすることである。たとえば溶融法では2000℃近い高温を必要とするシリカガラスは、ケイ素メトキシドSi(OCH3)4を出発物質として高純度のものが1000℃そこそこで合成できる特徴がある。化学蒸着法は、ケイ素、ホウ素、ゲルマニウムなどの塩化物の気体を必要量の酸素と混じて高温で反応させて、器壁や種棒にそれぞれの酸化物ガラスを蒸着させる方法で、単成分のものも複成分のものもつくることができ、不純物を10億分の1単位にまで低減でき、光通信用グラスファイバー製法の出発点となっている。この方法は現在、半導体用プロセスで使われるステッパー(半導体製造装置)用のレンズやフォトマスクなど、超高純度シリカガラスの合成に広く利用されている。
新しい製法が開発されれば、単にガラスの不純物含有率をいままでの限界以下に下げられるだけでなく、新しい化学組成のガラスをつくりだすことができる。透過率をはじめとする光学的性質や、高硬度、高強度、半導性などといった基本的物性の領域の拡大も可能となるので、エレクトロニクス、フォトニクス、バイオなどの分野で利用できる新しいガラス、金属、有機材料などとの複合材料等の範囲にまで発展することが期待される。
[境野照雄・伊藤節郎]
『日本セラミックス協会編『セラミック工学ハンドブック』第2版(2002・技報堂出版)』▽『作花済夫・伊藤節郎・幸塚広光・肥塚隆保・田部勢津久・平尾一之・由水常雄・和田正道編『ガラスの百科事典』(2007・朝倉書店)』▽『山根正之・安井至・和田正道・国分可紀・寺井良平・近藤敬・小川晋永著『ガラス工学ハンドブック』普及版(2010・朝倉書店)』
古代ガラス略年表
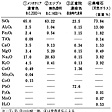
古代ガラスと天然ガラスの化学組成〔表1…

主要な実用的ガラスの化学組成〔表2〕

主要な実用的ガラスの特性〔表3〕

ガラスと他の物質の破壊強度〔表4〕

ガラス工業の種類〔表5〕

ガラスの主要原料〔表6〕
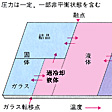
ガラスの性質〔図A〕
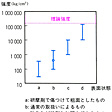
ガラスの強度と表面の影響〔図B〕
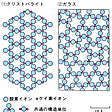
二酸化ケイ素の結晶(クリストバライト)…
同一化学組成のガラスと結晶の比容(定圧…
ガラス瓶の製造工程〔図E〕

ガラスの粘性率の温度による変化〔図F〕
ガラス瓶の機械成形過程〔図G〕

ベネチア・ガラスの工房


 4ポアズ,107ポアズ程度である。成形はかなり温度勾配の大きな状態でなされるから,成形後そのまま冷却すると残留ひずみと応力によって割れることがある。たとえ破壊に至らない場合でも残留ひずみは物性値のゆらぎと直接関係するので,徐冷(なまし)を十分行う必要がある。加工は,切断・研磨などのように機械的に行う場合,エッチングのように化学的に行う場合があり,そのほかに,金属や異種ガラスとの接合といったプロセスも加工に含まれる。機械加工には
4ポアズ,107ポアズ程度である。成形はかなり温度勾配の大きな状態でなされるから,成形後そのまま冷却すると残留ひずみと応力によって割れることがある。たとえ破壊に至らない場合でも残留ひずみは物性値のゆらぎと直接関係するので,徐冷(なまし)を十分行う必要がある。加工は,切断・研磨などのように機械的に行う場合,エッチングのように化学的に行う場合があり,そのほかに,金属や異種ガラスとの接合といったプロセスも加工に含まれる。機械加工には