デジタル大辞泉 「熱」の意味・読み・例文・類語
ねつ【熱】
2 病気などによる平常以上の体温。「三八度の
3 物事に打ち込むこと。ある事に精神を集中させること。熱意。「
4 ある対象に夢中になること。「旅行
5 物体の温度差の原因となるもの。高温の物体から低温の物体へ移動するエネルギーの流れ。分子や原子の運動に関連するエネルギーの一形態。
6 「熱病」の略。
[類語](1)(2)温熱・
翻訳|heat
温度の異なる物体があると必ず高温のほうから低温のほうへエネルギーが移る。このエネルギーが熱であり,したがって熱はエネルギーの一形態,正確にいうとエネルギーの移動における一形態である。
熱は人間の生活にきわめて深いかかわりがあるが,熱についての認識は力学などに比べるとはるかに遅れて進歩した。熱とは物体を暖める,あるいは熱くする何かであると考えられていたであろう。昔から太陽,火,摩擦運動,動物熱などがおもな熱源としてあげられている。熱の本性についての古代からの考え方は二つに大別される。一つは熱を火と同様に何らかの作用素,あるいは元素とみなすもので,のちに火のフロギストン説が現れたように,18世紀の熱素説につながる考えである。もう一つは原子論の立場に立って熱を運動の一種とする考えである。近代科学が誕生した17世紀にはどちらかというと後者の熱の運動論が支配的であった。F.ベーコンは《ノウム・オルガヌム》の中で,自然認識における正しい推論の例として熱の本性を問題にし,熱が小分子の運動であるという主張を詳しく展開している。R.ボイル,R.フック,I.ニュートンらもこの立場をとったが,当時は定性的な議論以上には出なかった。
一方,16世紀の終りころから温度計が使われるようになり,気体の膨張など熱現象の研究がようやく実質的な進歩を始めた。水の量が多いとそれだけ長く火にかけないと湯にならないといった日常経験から,熱の量と熱さ,すなわち温度とが漠然とではあっても意識されていたに違いないが,それをはっきり認識したのはイギリスのJ.ブラックであった。彼はG.D.ファーレンハイトらの研究に手がかりを得て,氷がとけるときに温度が変わらないこと,そのときに必要な熱で同量の水の温度を約80℃上げられることを明らかにし,さらに水の蒸発についても同様の事実を発見した。この潜熱の発見に続いてブラックは,1760年ころ熱容量の研究を始めた。物質によって同じ量を同じ温度上げるのに必要な熱量が異なることを示したのである。ブラックの研究に刺激されたA.L.ラボアジエは,P.S.ラプラスと協力して比熱の精密な測定を行った。ブラックらの研究によって初めて熱の量が測定される量として把握されたのである。
これらの研究では熱の量が保存されることが前提とされている。つまり一方の物体が失った熱は他方の物体が得た熱量に等しく,熱の生成消滅はないとしている。もしそうなら熱を何か物質的なものと考えるのが自然である。ブラックも一種の流体ではないかという考えを述べたが,ラボアジエは89年に発表した《化学要綱》の中で,熱の本性は熱素caloriqueという一種の元素であるとはっきり熱素説を主張した。それによると熱素はきわめて流動的な物質で物体中を自由に出入りし,分子間の距離を広げる役をする。
熱伝導の現象は19世紀の初めに研究が始められ,1822年にJ.B.フーリエによってその理論が与えられた。彼の理論では,熱は保存される量とみなされており,その成功は熱素説にとってつごうがよかった。しかし気体を真空中に膨張させたとき,分子間の距離は広がるはずなのに温度が変化しないことを示したゲイ・リュサックの実験のように,熱素説によって説明のつかない事実も明らかにされてきた。
18世紀の終りにはもう一つ重要な実験が行われた。砲身をくり抜くとき大量の熱が発生するのに驚いたランフォード伯(B. トンプソン)は,先を丸めたドリルを使い,水の中に入れた砲身にあてて回転させることにより,消費された仕事と発生した熱量との関係を調べたのである。彼は摩擦によって際限なく熱を発生できるのであるから,熱は運動に違いないと考えた。このランフォードの実験は19世紀になってH.デービー,J.P.ジュールらによって熱の仕事当量を定める精密な実験に発展した。
ランフォードに始まる研究は,仕事すなわち力学的エネルギーが熱に転化することを明らかにしたが,逆に熱から仕事をとり出す過程のほうの研究も,産業革命の主役,蒸気機関の改良という技術的要求から18世紀の半ばころから盛んになっていた。すでに1765年にJ.ワットは凝縮器を発明していたが,熱機関の理論的研究はS.カルノーによって始められた。彼は水が高いところから落下するとき水車を回すのと同じように,一般に熱機関では高温の熱源から低温のほうに熱素が移るときに動力が発生すると考えた。そしてどんな永久機関も不可能であるという原理から,同じ量の熱の移動で得られる仕事,すなわち効率は二つの熱源の温度だけで定まるはずであると推論した。カルノーの理論は,以下に述べるエネルギー保存則とともに熱の概念を最終的に確立する熱力学の基礎となったものである。
力学的エネルギーに加えて電磁気的エネルギー,化学的エネルギーそして熱エネルギーと,すべての種類の現象にかかわるエネルギー(19世紀後半になるまでは“力”と呼ばれていた)が,相互に変換され,しかもあらゆる過程で保存される量であるというエネルギー保存則は,19世紀後半になってR.マイヤー,ジュール,H.ヘルムホルツら多くの人々の貢献により広く認識されるようになった。しかし熱がエネルギーであるというだけでは不十分であって,温度およびエントロピーとの関係も含めて古典物理学の枠内で熱の概念が確立されたのは,R.クラウジウス,ヘルムホルツ,ケルビン(W. トムソン)らによって熱力学の体系が作られるのをまたなければならなかった。さらに,20世紀にかけてJ.C.マクスウェル,L.ボルツマン,J.W.ギブズらによって気体運動論,そして統計力学が形成され,物質を構成する原子・分子の力学から熱現象を理解することが可能となった。
→エネルギー →統計力学
ふつうわれわれが扱う物体は非常に多くの微視的な粒子(原子あるいはそれを作っている電子と原子核)から構成されている。そのため物体は静止しているときでも微視的な粒子の運動エネルギーや,粒子間の力に応じた位置エネルギーをその内部にもっている。これを内部エネルギーという。気体を例にとると,静止しているとき,いいかえると流れがないときでも気体分子は互いに衝突しながら乱雑な運動をしている。また固体でもその中の原子は乱雑なしかたで振動をしている。この乱雑な運動は熱運動と呼ばれ,温度が高いほど激しくなる。したがって他の条件が同じなら温度が高いほど物体のもつ内部エネルギーは大きい。ふつう,熱を与えるとか熱するというときには,より高温の物体と接触させるが,このとき原子や電子の衝突(相互作用)によって乱雑な運動が高温のほうから低温のほうへ伝えられ,それに伴ってエネルギーが移動する。このエネルギーが熱にほかならない。熱を与える(奪う)と物体の内部エネルギーがそれだけ増加(減少)し,温度が上(下)がる。
物体が外界とやりとりする熱ははっきりした意味をもつが,ある状態で物体が一定量の熱を内部にもっているということはできない。気体を熱して圧力を上げ,ピストンを動かすことができるように,与えた熱を仕事としてとり出す,あるいはその逆が可能であるからである。物体はその状態に応じた内部エネルギーをもっているのである。内部エネルギーを水槽の中の水にたとえると,その量を示す水面の高さが温度にあたる。
→温度
熱を与えると物体の温度が上がって膨張するとか柔らかくなるとかいろいろな変化が生ずる。あるいは固体がとけて液体になるといったいわゆる相変化が起こる。同一の物体に一定の変化を生じさせるのに必要な熱の量は一定であり,このことを利用して熱の量を測ることができる。よく使われる熱量の単位は,14.5℃の水1gの温度を15.5℃まで上げるのに必要な熱量であり,これを1カロリーと呼び,1calと表す。1000cal=1kcalも単位としてよく用いられる。
例えば水の温度を上げるには熱を与えるかわりに,ランフォードやジュールが行ったように摩擦によってもよいし,電流を流してやってもよい。また気体を圧縮すると温度が上がる。一般に熱力学の第1法則によると,同一の物体に一定の変化を生じさせるのに必要な熱と仕事(力学的,電気的,化学的エネルギーなどをひっくるめて仕事という)の和はつねに一定である。したがって一定の熱量には一定の仕事量が対応する。これを熱の仕事当量という。calと力学的エネルギーの単位であるJとの関係は,
1cal=4.186J
である。熱はエネルギーであるから,熱量を測るのにはerg,W・hなどエネルギーの単位のどれを使ってもよい。国際単位系(SI)では熱量の単位にもJを用いる。一例をあげると,1lの水の温度を約33℃だけ上げるのに必要なエネルギーと,重さ1tの自動車が時速60kmで動いているときの運動エネルギーとは等しい。
物体の温度を単位温度だけ上げるのに必要な熱量をその物体の熱容量と呼び,単位質量の物質の熱容量を比熱という。物質の比熱は一般に温度によって異なるし,また熱を加えるときの条件にも依存する。とくに体積一定にしたときの比熱を定積比熱Cv,圧力一定のときの比熱を定圧比熱Cpと呼ぶ。一般に後者のほうが大きな値をもつが,その理由は,加えた熱の一部が圧力に抗して膨張する仕事に使われるからである。常温の空気ではCv=0.7170J/g・K,Cp=1.006J/g・K,鉄ではCv=0.106J/g・K,Cp=0.110J/g・Kである。
固体がとけて液体になる,あるいは液体が気体になるときには,温度は変化しないが一定量の熱が吸収される(逆の過程では放出される)。前者は融解熱,後者は気化熱と呼ばれる。このように物質の相が変わるときに吸収あるいは放出される熱のことを潜熱という。氷の融解熱は79.7cal/g,1気圧,100℃における水の気化熱は539.8cal/gである。液体の水では水の分子どうしが引力によって凝集しているから,これをばらばらにして水蒸気にするにはエネルギーを与えてやらなければならない。これが気化熱である。
水の中にインキを落とすと拡散していく。熱は必ず高温から低温に流れる。物体の運動は摩擦や粘性によって減衰する。このように巨視的なスケールで生ずる過程は一方向に進む。この普遍的な非可逆性は熱力学の第2法則,すなわちエントロピー増大の原理として表現される。物体のある一つの状態には一定の大きさのエントロピーSが対応する。統計力学によるとエントロピーという量は,問題にしている(巨視的)状態においてどれだけ熱運動による乱れがあるか,すなわち微視的レベルでの無秩序さの度合を表す。
物体に熱を与えると原子の無秩序な運動が激しくなるからエントロピーは増大する。与えた熱量をQとすると物体のエントロピーの変化⊿Sとの関係は,Qが十分小さいとき,
Q=T⊿S
である。ここでTは物体の絶対温度である。これによると温度が高いほど同じ量の熱エネルギーによる無秩序さの増加は少なく,低いほど大きい。したがって熱が高温の物体から低温の物体に移るとき,全体のエントロピーは増大する。熱もエネルギーであるが,力学的エネルギーとの本質的な違いは熱のやりとりが必ずエントロピーの変化を伴うところにある。
孤立系,すなわち外界と熱や物質のやりとりがなく,また力も及ぼしあわない物体の集りを放置しておくと,もはや何の変化も生じないエントロピー最大の状態になる。これを熱平衡状態という。
→エントロピー
ふつう,摩擦で熱が出るとか,抵抗に電流を流すとジュール熱が発生するとかいう。摩擦熱の場合は物体表面で原子間力によって物体全体の運動が原子の乱雑な熱運動に変わったものである。またジュール熱も電子の衝突によって電流が減衰し,電気的エネルギーが電子やイオンの乱雑な運動のエネルギーになったものである。正確には物体の運動エネルギーや電磁気的エネルギーが内部エネルギーになるといわなければならないが,これらの過程ではつねにエントロピーが増大するから,熱が発生するといういい方をする。
熱源としてもっとも重要なのは,燃焼のような化学反応や,核分裂,核融合のような原子核反応である。これらの反応では,原子あるいは原子核が反応の前よりもエネルギーの低い状態になる。その差のエネルギーは粒子の運動のエネルギーとして放出され,そのために温度が上がる。例えば水素ガスが燃える反応2H2+O2─→2H2Oでは,水素1g当り約34kcalの熱が発生する。反応の種類によっては熱を吸収する場合もあるが,一般に反応が生ずるとき,温度一定に保つために吸収あるいは供給しなければならない熱量を反応熱という。
熱は必ず高温から低温のほうへ伝わるが,その機構は,(1)物質の移動を伴わない,いわゆる熱伝導,(2)物質の移動による伝達,(3)放射による伝達に分けられる。熱伝導は原子・分子あるいは電子などの乱雑な熱運動が物体内で平均化される過程である。温度こう配があまり大きくないときには伝えられる熱量は温度こう配に比例する(フーリエの法則)。
(2)の機構としてもっとも重要なのは熱対流である。気体・液体では例外的な場合を除いて温度を上げると密度が小さくなる,つまり軽くなるため,下部が熱せられると対流が生ずる。対流が起こると熱伝導によるよりもはるかに大きな熱が移動する。また高温の部分で液体の気化,低温のところで気体の液化が起こるようにし,かつ液体は低温から高温部へ,気体は逆に流れるようにすると,気化熱が伝達されることになる。これを利用したのがヒートパイプである。
乱雑な熱運動をしている原子は光子,すなわち電磁波の量子を放出するため,一般に物体は表面から放射を放出したり吸収したりする。これが(3)であり,熱放射と呼ぶ。その強さは黒い物体の場合表面の温度の4乗に比例する。したがって温度の高い物体と低い物体とが真空中に離れてあっても熱放射によって熱が伝えられる。太陽熱はその一例である。
蒸気機関や内燃機関のように熱から仕事を得る装置を一般に熱機関という。熱力学の第2法則によると熱機関には必ず高温の熱源と低温の熱源が必要であり,高温の熱源から得た熱の一部が仕事となり残りが低温の熱源に与えられる。理想的な熱機関ではすべての過程が可逆的に行われ,エントロピーの増大を伴わない。その効率は二つの熱源の温度だけで定まる。このことを利用して定義されるのが絶対温度である。逆にモーターを回したりして仕事を行い,温度の異なる熱源の間に熱を移す装置を熱ポンプという。
→熱力学の法則
執筆者:恒藤 敏彦
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報

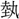 (げい)+火。
(げい)+火。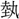 は
は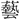 (芸)の正字で、〔説文〕三下に「種(う)うるなり」とあって、種芸の意。熱十上には「
(芸)の正字で、〔説文〕三下に「種(う)うるなり」とあって、種芸の意。熱十上には「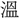 なり」と訓し、
なり」と訓し、 声とするが、声が合わず、「
声とするが、声が合わず、「 (や)く」という字と声義が近い。おそらく草を
(や)く」という字と声義が近い。おそらく草を く意であろう。暑熱の意となり、また〔孟子、万章上〕「君に得ざれば則ち熱中す」のように、心的な状態にも移していう。
く意であろう。暑熱の意となり、また〔孟子、万章上〕「君に得ざれば則ち熱中す」のように、心的な状態にも移していう。 (ねつ)を
(ねつ)を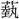 (げい)声とするが、熱と同声であるから、
(げい)声とするが、熱と同声であるから、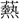 は熱声とすべきであろう。
は熱声とすべきであろう。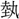 声の字とはすべて声が異なる。炎部十上に
声の字とはすべて声が異なる。炎部十上に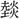 (ぜん)があり、「湯中に於て
(ぜん)があり、「湯中に於て を
を (や)くなり」とし、字を熱の省文に従うとする。犬肉を炙(や)くを然(ぜん)というので、その系統の語であろう。
(や)くなり」とし、字を熱の省文に従うとする。犬肉を炙(や)くを然(ぜん)というので、その系統の語であろう。 ▶・熱灰▶・熱旱▶・熱官▶・熱寒▶・熱気▶・熱記▶・熱狂▶・熱血▶・熱羹▶・熱酒▶・熱熟▶・熱暑▶・熱照▶・熱食▶・熱心▶・熱勢▶・熱誠▶・熱啜▶・熱喘▶・熱瘡▶・熱燥▶・熱中▶・熱腸▶・熱鉄▶・熱天▶・熱斗▶・熱湯▶・熱鬧▶・熱毒▶・熱罵▶・熱飯▶・熱病▶・熱風▶・熱腹▶・熱望▶・熱霧▶・熱辣▶・熱烈▶
▶・熱灰▶・熱旱▶・熱官▶・熱寒▶・熱気▶・熱記▶・熱狂▶・熱血▶・熱羹▶・熱酒▶・熱熟▶・熱暑▶・熱照▶・熱食▶・熱心▶・熱勢▶・熱誠▶・熱啜▶・熱喘▶・熱瘡▶・熱燥▶・熱中▶・熱腸▶・熱鉄▶・熱天▶・熱斗▶・熱湯▶・熱鬧▶・熱毒▶・熱罵▶・熱飯▶・熱病▶・熱風▶・熱腹▶・熱望▶・熱霧▶・熱辣▶・熱烈▶ 熱・酒熱・暑熱・昭熱・焦熱・焼熱・情熱・溽熱・盛熱・赤熱・積熱・地熱・中熱・低熱・湯熱・毒熱・内熱・白熱・発熱・微熱・伏熱・平熱・夜熱・余熱
熱・酒熱・暑熱・昭熱・焦熱・焼熱・情熱・溽熱・盛熱・赤熱・積熱・地熱・中熱・低熱・湯熱・毒熱・内熱・白熱・発熱・微熱・伏熱・平熱・夜熱・余熱出典 平凡社「普及版 字通」普及版 字通について 情報
物体の温度変化の原因になるものを熱という。たとえば、やかんに水を入れて熱すると、しだいに水の温度は上昇する。これは、やかんの水に熱が加わったためである。また、40℃の水1000グラムと60℃の水1000グラムを混ぜると50℃の水2000グラムになる。このように熱に関する量というものが考えられ、その量を熱量という。熱量の単位として、よくカロリー(cal)が使われる。1カロリーは、水1グラムの温度を1Kだけ(正確には 14.5℃から15.5℃まで1℃だけ)上げるのに必要な熱量である(温度差を表すとき℃のかわりにKの記号を用いる)。そのため、熱の粒子のようなものがあって、その密度が温度であると考えられたこともあり、その粒子は熱素(カロリック)とよばれた。この考え方は熱素説という。
しかし、熱は高温から低温に移動するだけでなく摩擦などによって発生し、力学的な仕事が熱に変わる現象は、多くの人により注目されていた。なかでも、19世紀のなかばごろ、イギリスの物理学者ジュールは、後述のような方法で、仕事と熱との関係を詳しく研究した。その結果、熱はエネルギーの一種であることがしだいに明らかになってきた。今日では、熱は物質の一種ではなく、エネルギーの一種であるという考えが確立している。また、熱に関連したエネルギーは熱エネルギーとよばれている。そのため、熱量は仕事の単位であるジュール(J)でも表される。
[宮下精二]
大砲などをつくる際に金属を削ると非常に熱くなることから、摩擦によって熱が発生することは早くから認識されていた。ジュールはのような装置を用いて摩擦によって発生する熱と、そのとき用いられたエネルギー(仕事)の関係を明確にした。この装置では仕事をおもりの位置のエネルギーで測っている。つまり、左右のおもりの重さをm[kg]、移動の距離をh[m]とすると位置のエネルギーの量はmgh[J]である。ここでgは重力加速度である。このエネルギーは羽根車の回転エネルギーとなり、水との間の摩擦によって熱に変わる。どのくらいの熱が発生したかは水の温度変化からわかる。それらを比較することで、熱と仕事の変換公式、つまり熱の仕事当量
1cal=4.18605J
が求められた。
この実験では仕事を位置のエネルギーで測っている。電気的な仕事である電線に電流が流れるときに発生するいわゆるジュール熱を用いると実験はもっと簡単なように思えるが、その当時は電気的な仕事への理解が十分でなかったため、より直観的な位置のエネルギーを用いたといわれている。
また逆に、熱から仕事への変換も考えられ、熱を仕事に転化するような装置は熱機関とよばれる。しかし、その場合、熱源からとり出した熱はすべての熱を仕事に変えられない。どのくらいの割合が仕事に変えられるかは熱機関で用いる熱源の温度によって決まっており、その比は変換効率(熱機関の仕事効率)とよばれている。熱機関の研究が熱力学の研究の基であった。
[宮下精二]
熱はエネルギーの一形態であるが、通常の仕事として表されるエネルギーとは異なる性質をもつ。熱湯を入れたやかんを洗面器中の水に浸し放置しておくと、湯(高温部)の温度は下がり、逆に水(低温部)の温度は上がる。しかし、決して逆の現象は起きない。通常の粒子の運動では、勢い、つまり運動エネルギーがあるが、熱の移動の場合はこれに相当するものがない。この性質は熱力学第二法則とよばれる。ちなみに、仕事と熱の和が保存される(変化しない)ことが熱力学第一法則である。
[宮下精二]
熱力学では物質の巨視的性質だけに注目し、それが多数の原子、分子などから構成されているという微視的な立場はとらない。微視的観点からみた熱とはなんであろうか。熱とは、仕事として表せないエネルギー、つまり運動形態を把握できないエネルギーである。しかし、把握できるかどうかは恣意(しい)的なものであり、その運動がどのようなものであるかがわかった瞬間、それは熱でなくなる。気体の運動エネルギーが熱であるといわれるが、それは運動が見えないことを前提としている。ミクロな識別能力をもつ人にとって熱は存在せず、力学的運動がすべてである。そのため、ミクロな識別能力をもつものをマクスウェルの魔物と称し、それによって熱力学の法則を破ることができることが議論されている。ミクロな立場から熱現象を扱う統計力学においては、認識レベル(通常エネルギーが同じ状態は区別できないとする)を規定し、それによって区別できない状態の数をエントロピーとすることでこの問題を解決している。
[宮下精二]
体温の調節機能が種々の原因によって異常をきたし、正常体温(平熱)以上になった状態をいい、発熱あるいは熱があるともよばれる。体温には個人差があり、同一人でも日周期リズムといって朝の起床時と日中では1℃以内の変動がみられるほか、検温部位によっても異なる。したがって、体温の比較は一定時間に検温したものが必要で、正常体温は通常わきの下で少なくとも10分間検温して37℃以下である場合をいう。
発熱はその程度によって微熱(37~37.9℃)、中等度発熱(38~38.9℃)、高熱(39℃以上)に分けられるが、臨床的には微熱は少なくとも10日間以上持続するものをさし、高熱を出す疾患に比べると一般に予後のよいものが多い。また高熱の場合は、数日から2週間くらい持続する短期間のものと、それ以上持続する長期間のものとがあり、感染症、膠原(こうげん)病、悪性腫瘍(しゅよう)、その他の疾患が含まれるが、予後の良好なウイルス性疾患は短期間のものが多い。一般に高熱は、その熱型(ねつけい)に従って稽留(けいりゅう)熱、弛張(しちょう)熱、間欠熱などに分けられる。
なお、下熱(解熱)の仕方も疾患によって特徴があり、高熱から6~12時間くらいの比較的短時間のうちに急速に正常体温まで下降するものを分利crisis(分利性下熱)といい、大葉性肺炎などにみられ、多くは発汗を伴い脈拍も正常に復してくる。しかし、分利状の体温下降がみられるが、まもなく体温が再上昇するものがあり、これを仮性分利といい、この場合は脈拍の正常化がみられない。また、分利に対して渙散(かんさん)lysis(渙散性下熱)とよばれるものは、高熱が数日から数週かかって徐々に下熱する場合をいい、大多数の熱性疾患の下熱の際にみられ、腸チフスや気管支肺炎などが代表的である。
発熱は疾患の軽重、軽快と増悪、転機を知るために重要な手掛りとなり、とくに典型的な熱型は診断にも役だつところから、臨床的には発熱に対してそのまま観察する例が多い。しかし、発熱は代謝を促進させて体内のタンパク質を消耗させるほか、心臓への負荷も大きく、発汗による水や電解質の喪失など、全身状態を悪化させるので、その対策を講ずる必要がある。また、高熱を出す疾患にかかりながら発熱が軽微であったり、まったく発熱を認めない場合は重症であるか、または患者の衰弱を示すものであり、予後に注意する必要がある。なお、小児では成人より通常1℃くらい体温の上昇が著しくなるほか、老人や衰弱した患者では逆に著明な発熱をきたしにくいので、あらかじめ用心する。
治療としては、発熱に対する原因療法とともに対症療法を行う。いたずらに解熱剤によって頻回に下熱させることは、精神的にも肉体的にも患者を消耗させることになる。しかし、老人や衰弱している患者、循環器疾患、熱射病や日射病、ショック患者、うわごとをいう患者などに対しては、冷罨法(あんぽう)などにより体を冷却し、解熱剤などを投与して速やかに下熱させる必要がある。
[柳下徳雄]
出典 株式会社平凡社百科事典マイペディアについて 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
はじめ,熱は熱素という一種の物質と考えられていたが,19世紀半ばごろ,熱力学第一法則が確立されて,熱は物質の状態変化に即して考えられる物理量とされた.物質がある定まった条件のもとで温度変化をするとき,物体は熱量を得る,または失うという.[別用語参照]熱量の単位
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
…〈さかり(heatまたはrut)〉ともいう。広義には動物が交尾可能な生理状態にあることをいうが,狭義には成熟した哺乳類の雌が,雄の接近を許し,交尾に応じることのできる生理状態にあることをいう。…
…上式は保存力のときは,位置エネルギーまで含めた力学的エネルギーが物体の運動の際,状態が変わっても変化しないという(力学的)エネルギー保存の法則(エネルギー保存則)である(実質的にはJ.L.ラグランジュによって1811年に与えられた)。
[熱とエネルギー]
力学的エネルギーの保存則は現実には満たされない場合が多い。現実の運動にはかならず摩擦や粘性抵抗などが関係し,保存力以外の力(非保存力)を考えねばならないからである。…
※「熱」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
二十四節気の一つ。元来,太陰太陽暦の 12月中 (12月後半) のことで,太陽の黄経が 300°に達した日 (太陽暦の1月 20日か 21日) から立春 (2月4日か5日) の前日までの約 15日間で...
1/16 デジタル大辞泉プラスを更新
1/16 デジタル大辞泉を更新
12/10 小学館の図鑑NEO[新版]魚を追加
10/17 ブリタニカ国際大百科事典 小項目事典を更新
8/22 日本大百科全書(ニッポニカ)を更新