日本大百科全書(ニッポニカ) 「タンパク質」の意味・わかりやすい解説
タンパク質
たんぱくしつ
protein
約20種のL-α(アルファ)-アミノ酸が酸アミド結合(ペプチド結合)によって、それぞれ固有の配列順序で約50個以上連結した高分子含窒素化合物の総称。タンパクということばは、ドイツ語のEiweißの訳語で卵白を意味する。卵白は、身近にある代表的なタンパク質の一つである。国際的にはプロテインproteinとよばれている。スウェーデンのベルツェリウスは「生体の構成単位として、また代謝物質として第一に重要な物質」という意味で、ギリシア語のproteios(第一)にちなみ、プロテインと命名することを提唱した。1839年にオランダの化学者ムルダーGerardus J. Mulder(1802―1882)により初めてこのことばが用いられた。タンパク質はこのことばどおり、すべての細胞の原形質の主成分であり、細胞内でおこっているすべての生命現象に直接深く関係しているので「タンパク質のない生命はない」といわれている。タンパク質は核酸と並んで生物を支える二つの大きな柱である。
[内田庸子]
存在
タンパク質は細胞の乾燥重量の約60%を占め、ヒト細胞にはほぼ1万種類のタンパク質があると考えられている。ヒトゲノムの解析結果ではヒトの遺伝子は約3万個、それから読み取られるタンパク質は5~10万種類程度と推定されている。
細胞の生活機能は物質代謝、エネルギー代謝によって営まれているが、これらの代謝系を構成するたくさんの化学反応を触媒して円滑に進めている酵素は、そのほとんどがタンパク質を主体としている。一般に酵素は、特定の物質の特定の反応だけを触媒する特異性をもつため、その種類は非常に多い。血液の輸送機能をはじめ、細胞の生理機能を調整するシグナル伝達、ホルモン受容体作用、遺伝子の発現調節、免疫、毒性など酵素以外の生物学的活性を備えたタンパク質や、これらの生物機能が発現される場を形成する構造タンパク質も細胞には含まれている。また、種子、卵、血液などに含まれるある種のタンパク質や乳汁のタンパク質のように、特別の機能をもたない貯蔵用のタンパク質もある。さらに動物の毛、つめなどのように保護作用をしているタンパク質もある。
[内田庸子]
分類
タンパク質は構造も機能もさまざまなので、系統だてた分類をするのはむずかしい。したがって、次のようないくつかの分類法を適当に組み合わせて使用している。
〔1〕分子の形による分類 球状タンパク質と繊維状タンパク質(硬タンパク質)に分けられる。球状タンパク質は、卵白アルブミン、血清アルブミン、ヘモグロビンなどのように、水や塩の希薄溶液に溶けやすく、球に近い形状で結晶化しやすい。繊維状タンパク質は、毛髪やつめをつくっているケラチン、皮膚や腱(けん)をつくっているコラーゲンなどのように、繊維状をしていて水に不溶性、生物学的に不活性で、生物の支持物質や骨格物質として役だっている。
〔2〕構成成分による分類 次の三つに大別される。(1)単純タンパク質 α-アミノ酸だけからできているタンパク質で、アルブミン、グロブリン、硬タンパク質などの多くが属している。(2)複合タンパク質 アミノ酸以外に核酸、糖、脂質、リン、色素、金属イオンなどの有機物質や補欠分子族を含むタンパク質で、含まれる成分の種類によって核タンパク質、糖タンパク質、リポタンパク質、金属タンパク質などとよばれる。(3)誘導タンパク質 天然のタンパク質がなんらかの変化を受けてできたもので、ゼラチン、変性タンパク質などがこれに属する。
〔3〕溶解度による分類 可溶性タンパク質と不溶性タンパク質に分けられる。
〔4〕電気的性質(等電点)による分類 酸性アミノ酸と塩基性アミノ酸の含量の差によって、酸性タンパク質、中性タンパク質、塩基性タンパク質の三つに分けられる。
〔5〕局在性による分類 細胞内タンパク質、膜タンパク質、分泌タンパク質などに分けられる。
〔6〕生物学的活性による分類 タンパク質のもつ機能によって、酵素タンパク質、シグナルタンパク質、受容体タンパク質、遺伝子調節タンパク質、免疫タンパク質、ホルモンタンパク質、毒素タンパク質というように分類される。
〔7〕出所や起源による分類 主として栄養学的に用いられる。動物性タンパク質と植物性タンパク質に大別され、さらに卵タンパク質、乳タンパク質、血漿(けっしょう)タンパク質、筋肉タンパク質、種子タンパク質などに細分される。
[内田庸子]
構造
元素組成は炭素50~55%、水素6.9~7.3%、窒素15~16%、酸素19~24%、硫黄(いおう)1~2%で、そのほかに微量の灰分を含むこともある。分子量は小さいもので約5000から、大きなものは数千万から数億(ウイルスタンパク質)に達する。分子量5000以下のものは通常ポリペプチドとされているが、その境界は厳密ではない。また通常、10万程度以上のタンパク質では複数のポリペプチド鎖(サブユニット)から構成されている場合が多い。分子量は、沈降平衡法(種々の濃度の高分子溶液を超遠心機で長時間遠心して、溶質の沈降と拡散の平衡状況における濃度分布から溶質の分子量を求める)、光散乱法(光が高分子溶液に当たると放射される散乱光の強度は分子量と重量濃度の積に比例することから、その散乱光を測定して高分子溶液中の分子量を求める)などによって測定できる。1970年代後半以降、SDS(sodium dodecyl sulfate)‐ゲル電気泳動法またはゲル濾過(ろか)法によって微量で簡便に測定することが多くなった。
タンパク質の構造には、一次、二次、三次、四次構造の階層性がある。このうち、一次構造は化学的方法により、二次以上の高次構造はおもに物理的あるいは物理化学的方法によって解明されている。
[内田庸子]
一次構造
約20種のアミノ酸がペプチド結合()で結合し、1本の紐(ひも)状のポリペプチド鎖()を形成する。タンパク質により構成アミノ酸の残基数、組成、結合順序は固有でまったく異なっている。またペプチド鎖中のシステイン残基間でジスルフィド結合(-S-S-)をつくり、ペプチド鎖内部またはペプチド鎖間に架橋構造を形成する。タンパク質分子中のアミノ酸の結合順序(配列)は、その合成を支配しているDNA鋳型により遺伝的に定められている。このアミノ酸の配列順序と、-S-S-結合が存在するときはその結合位置も含めた一次元的化学構造を一次構造という。一次構造の決定法は、1954年イギリスのF・サンガーが51個のアミノ酸からなるホルモン、インスリンの配列決定に成功してほぼ確立された。その後、1959年にウシの膵臓(すいぞう)のリボヌクレアーゼ(124個)、1961年にタバコモザイクウイルスのタンパク質(158個)、ヘモグロビン(574個)などの一次構造が相次いで決定され、DNAの塩基配列決定法が確立された1978年までに250種類に近いタンパク質について、また起源を異にする同種タンパク質を含めると1100個を超える数の完全一次構造が決定された。DNAの塩基配列が容易に決定されるようになり、その結果からタンパク質の一次構造が推定されるので、一次構造既知のタンパク質の数は急激に増加している(2003年6月の時点で、タンパク質のデータバンクSwiss-Protには11万9866配列が登録されている)。1990年代に入ると、質量分析法も有力な手段となってきた。
[内田庸子]
二次構造
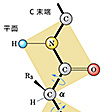
1本のポリペプチド鎖のとる立体構造は、まったく無秩序な糸玉状の構造(ランダムコイル)か、あるいは規則的な構造であるかもしれない。このような立体的構造を二次構造という。ペプチド鎖を形成するためには、(1)構成アミノ酸はL型の立体配置をとり、各アミノ酸の側鎖は二次構造に影響しない(プロリンは例外)。(2)主鎖()を形成する原子の結合角や結合距離は一定である。(3)ペプチド結合は自由な回転ができないので、ペプチド結合に含まれる原子は同一平面上にある()、という条件を満たさなければならない。すなわち、ペプチド結合を挟む二つのα-炭素はより安定なトランス構造をとり、2枚のペプチド結合平面相互の回転角も安定化のためある程度制限される。さらにペプチド結合のカルボニル基とイミノ基の間に、できるだけ多数の水素結合を形成して安定化するように主鎖を折り畳む(フォールディング)とすると、存在しうる二次構造はわずかな種類しかない。
1951年アメリカのポーリングらは、模型を用いた理論的考察から、(1)同一ペプチド鎖内で水素結合が飽和された右巻きα-螺旋(らせん)構造(α-ヘリックス=ポリペプチド鎖がとりうる安定な螺旋構造の一つ)と、(2)互いに逆行または平行する2本のポリペプチド鎖間で水素結合をつくったβ(ベータ)-シート構造(ひだ付きシート状構造)の二つの二次構造を提案した。その後、各種の精製タンパク質のX線結晶解析が進むにつれ、この二つの二次構造は部分的ではあるがほとんどの天然タンパク質分子中に存在することが実証された。赤外吸収、旋光度、円二色性(発色団付近の不斉分子の立体構造の決定に役だつ。不斉性を示すα-ヘリックス、β-シートはその構造特有の円二色性スペクトルを示す)などの解析からもこれらの規則構造の存在は支持されている。また繊維状タンパク質である絹フィブロインは、平行型β-シート構造をとる代表的なものとして知られている。なお、アミノ酸残基によって、これらの二次構造は、安定化されたり不安定化されたりする。この各アミノ酸の安定化・不安定化の傾向から、β-シート構造とα-ヘリックスの形成を予測する方法が提案され、その的中率は70~80%である。
[内田庸子]
三次構造
1本のポリペプチド主鎖のなかで、α-ヘリックスやβ-シート構造などの二次構造をとった部分が不規則構造部分を介してさらに折り畳まれ、一定の配置をとって形成される立体構造を三次構造という。とくに一つの三次構造中で構造的、機能的にまとまった構造単位をドメインという。タンパク質は一般にいくつかのドメインで構成されている。同じような機能を示す異種タンパク質のドメイン間で相同性がみられることが多い。
天然の三次構造を形成するための主要な力は、アミノ酸の側鎖間のさまざまな非共有結合による相互作用である。すなわち、疎水性(水と相互作用せず、水分子と親和性の少ない性質)側鎖間の疎水結合(疎水基が水溶液中で互いに集まろうとする相互作用)、特殊な側鎖間に生ずる水素結合、静電的引力、シスチン残基間のジスルフィド(-S-S-)結合などによって折り畳まれたペプチド鎖間は相互に結び付けられ、安定化される。なかでも疎水結合の寄与は大きい。とくに多くの球状タンパク質では、分子内部は安定した疎水領域を形成し、分子表面にイオン性側鎖が出て親水性(水と相互作用し、水分子と親和性の大きい性質)を保持するように進化の過程で一次構造が選ばれてきている。もっとも安定な天然の三次構造は、一次構造に依存してほぼ決まっていると考えられている。もちろん、ほかにいくつかの可能な構造が存在し、それらとの間には動的、可逆的な平衡関係があり、環境の水素イオン濃度(pH)、組成、温度などによって、また酵素であれば基質の存在の有無によって変化する。このような三次構造の変化は、チロシン、トリプトファン、フェニルアラニンなどの芳香族アミノ酸残基の特異吸収帯を利用するUV差スペクトル法、蛍光法、円二色性(CD)スペクトル法などにより追跡することができる。
二次、三次構造を含めた立体構造は、そのタンパク質分子が結晶として得られ、一次構造が既知であるならば、X線解析によって非常に正確に決めることができる。1958年、初めてイギリスのケンドルーらによってヘムタンパク質、ミオグロビンの立体構造が明らかにされたのに続いてヘモグロビン、リゾチーム、リボヌクレアーゼなど多くのタンパク質の立体構造が決定されている。また、酵素分子と低分子の基質類縁体との共晶の解析から、活性発現時の立体構造や基質との結合様式を推測することもできる。1980年代に入ると、核磁気共鳴(NMR)法によっても、溶液中でのタンパク質分子の立体構造や基質との相互作用、タンパク質分子間の相互作用などについて情報を得られるようになった。とくに1985年、スイスのビュートリッヒにより初めてNMRを用いて水溶液中のタンパク質の立体構造が提出されてから、NMRは溶液中の立体構造決定法として重要性が増した。タンパク質のもつ特異的な生物活性は、その分子に特有の立体構造によるものであることが明確となり、1990年代後半からの構造生物学(X線結晶解析、NMRなど)の発展に伴い、タンパク質の立体構造の解析は飛躍的に進展した(2003年6月現在、データバンクPDBに登録された立体構造は2万1248に達した)。
[内田庸子]
四次構造
タンパク質には種々の試薬によって不活性なサブユニットに解離するものがある。分子量が数十万、数百万の巨大な活性タンパク質は多数のサブユニットから構成されているのが普通である。電子顕微鏡で見ると、ウイルスは多数のサブユニットが規則正しく配列して一つの高分子会合体を形成している。このように、サブユニットが相互に特定の空間配置をとることを四次構造という。この小単位を会合させて活性タンパク質をつくる力は個々のペプチド鎖を正しい立体構造に折り畳む力と同じものである。四次構造をとるメリットは次のような例にみられる。生理機能の調節を行うアロステリックタンパク質は複数のサブユニットから構成され、サブユニット間の相互作用の変化により単量体ではもちえない新しい機能を発揮する。
電子顕微鏡による観察は、四次構造研究の主要な手段である。2000年代に入ると、クリオ電子顕微鏡(極低温電子顕微鏡)による構造解析が進み、タンパク質合成の場であるリボソーム(リボゾーム)粒子(直径約20ナノメートル)とそれに作用する種々の翻訳因子(アミノアシルtRNA=転移RNAなどのtRNA誘導体、ピューロマイシン、エリスロマイシンなどの阻害剤など)との複合体の構造解析までできるようになった。X線結晶解析の能力も向上し、上述のような大きなRNA‐タンパク質複合体も精密に、迅速に解析されている。
[内田庸子]
性質
(1)溶解性 可溶性タンパク質は一般に水または希塩類溶液に溶ける。通常、単分散溶液となるが、コロイド的性質を示す。生物の運動にかかわる収縮性タンパク質アクトミオシンのようにゲル状を呈するものもある。溶解性はタンパク質の種類によって著しく異なり、相互の分離精製に利用される。
(2)等電点 溶液状態では溶媒の水素イオン濃度(pH)により酸としても塩基としても存在しうる両性電解質の性質を示し、そのタンパク質固有の等電点を示す。通常、等電点付近でもっとも難溶となる。
(3)塩析 タンパク質の溶解度は塩類の共存によって変化する。低濃度の電解質では溶解度が上昇し(塩溶salting-in)、高濃度では低下して沈殿を生ずる(塩析salting-out)。塩析による溶解度の変化は、タンパク質の種類、塩(おもに陰イオン)の種類、pH、温度などに支配される。塩析はタンパク質の除去、精製に利用されてきた。
(4)有機溶媒 エタノール(エチルアルコール)、アセトンなどの有機溶媒により沈殿する。沈殿を生ずる有機溶媒の濃度はタンパク質によって異なるので、分別に利用される。
(5)紫外線吸収 タンパク質溶液は分子内の芳香族アミノ酸残基の特異吸収により、280ナノメートル付近に吸収極大を示す。
(6)呈色反応 ペプチド結合に基づいて、または構成アミノ酸の側鎖の官能基の反応性に基づいて種々の呈色反応を示す。これらはタンパク質の検出や定量に利用されてきた。おもな反応としてビュレット反応、キサントプロテイン反応、ミロン反応、ホリン反応(タンパク質の定量法。アルカリ性銅の存在でフェノール試薬を作用させると、チロシン、トリプトファン、システインによる発色とペプチド結合由来の呈色がある)、リーベルマン反応、アダムキービッツ反応(トリプトファンの呈色反応。グリオキシル酸試薬を加え、濃硫酸を滴下すると赤紫色に呈色)、パウリ反応(ヒスチジンの呈色反応。スルフファニル酸と亜硝酸ナトリウムを作用させる。チロシンも黄橙色に呈色する)、坂口反応(アルギニンの検出法。アルカリ溶液α-ナフトールと次亜塩素酸を作用させると赤色呈色)、ニンヒドリン反応(アミノ酸の検出、定量法。アミノ基と反応して赤紫色を呈する)などが知られている。1980年代後半には、ダンシルクロリド(N-末端アミノ酸標識法。弱アルカリ性でタンパク質に作用させるとアミノ基と反応して、蛍光を発するダンシル誘導体となる)やフルオレサミン(ほぼ瞬間的にアミノ基と反応する蛍光標識試薬)などの蛍光色素(フルオレセイン、ローダミン)を結合させる高感度検出法も開発され、高感度アミノ酸配列分析計に応用された。また、蛍光色素と抗体の組合せで特定のタンパク質の生体内in vivoでの局在、検出、定量などに用いられている(蛍光組織化学法、蛍光抗体法)。
(7)加水分解 強酸(6N塩酸)中で加熱すると加水分解され、その構成L-α-アミノ酸になる。この方法はアミノ酸組成の測定に用いられている。強アルカリや種々のタンパク分解酵素(プロテアーゼ)によっても加水分解される。明確な特異性のタンパク分解酵素による加水分解は、一次構造決定の重要な手段である。
(8)変性 種々の原因で、一次構造は変化せずに高次構造だけが破壊され、天然タンパク質とは異なる物性を示すようになることを変性という。変性の原因としては、極端なアルカリ性または酸性、有機溶媒、重金属塩、尿素や塩酸グアニジンなどの変性剤、界面活性剤、酵素などの化学的因子のほかに、加熱、凍結、攪拌(かくはん)、希釈、吸着、紫外線、X線、高圧、超音波などの物理的因子もあげられる。変性による物性の変化としては、生物活性の減少または喪失が第一にあげられるが、ほかに溶解度の減少、粘性や沈降定数など流体力学的定数の変化、旋光性、吸収スペクトル、側鎖の官能基の反応性、タンパク分解酵素の作用の受けやすさなどがある。つまり、変性すると、タンパク質の二次、三次構造を維持している非共有結合による相互作用が崩れ、折り畳まれた立体構造からランダムコイルに変化する。同時に四次構造も崩れてサブユニットへの解離を伴う。変性をおこす要因、条件によって、この変化は可逆的(再生)であることも、非可逆的であることもある。変性に耐える力、すなわちタンパク質の安定性は、タンパク質によって異なり、1個のアミノ酸の置換で大きく変動することもある。界面活性剤(SDS)存在下での変性タンパク質の電気泳動やゲル濾過は、分子量の決定に用いられている。
1990年代に入って、アルツハイマー病、プリオン病をはじめとする神経疾患では、神経細胞内に存在する正常タンパク質が何らかの原因で構造変化をおこし、細繊維性の凝集塊を形成して神経細胞の脱落を引き起こしているとみなされるようになった。そこでタンパク質の変性過程の詳細な解析が求められている。また、遺伝子工学法によるタンパク質の合成などの実用的見地から確実な再生法の研究も望まれている。
(9)免疫 天然タンパク質は抗原性をもっている。異種の動物組織に注入すると、動物は免疫ができて、そのタンパク質(抗原)に対する特異的抗体をつくる。抗体もまたタンパク質であり、抗原タンパク質と特異的に結合して不溶性の複合体を形成する(抗原抗体反応)。抗体は抗原以外のタンパク質とは反応しないので、タンパク質の微量検出や同定に利用され、プロテオミクス(生体内で発現するタンパク質の構造と機能を網羅的に解析する)の有力な手段となってきている。
(10)特異性 タンパク質の種類は無限であるといってもよい。まったく同じ機能をもち、同名のタンパク質でも、生物種が異なると、その構造は多少異なる。これをタンパク質の種属特異性という。生物の種属がかけ離れ、進化の経過年代の長いものほどこの種属差は大きい。相同タンパク質中のアミノ酸の変換率から、進化の順序や分岐年代を推定することができる。高等動物では同一個体でも器官が異なると多少構造の異なることがある。これを器官特異性という。このことは、生物活性を発揮するには、かならずしも分子全体が厳密に一定の構造をとる必要はないことを示している。
結局、タンパク質の特徴は、(a)多様性がある、(b)特異性を示す、(c)生物学的活性をもつ、(d)変性しやすい、(e)抗原性をもつ、の5点である。
[内田庸子]
分離・精製
タンパク質の精製には、変性をおこさない条件下で全操作を行うことが必要である。可溶性タンパク質の場合には、細胞の破砕後、水または希薄塩類溶液で抽出した抽出液を出発物質とする。不溶性タンパク質の場合にも、有機溶媒による脂質の除去、弱い界面活性剤による可溶化、脂質や構造タンパク質の酵素分解などの穏やかな処理で、生物活性をもったまま可溶化されることもある。まず、タンパク質相互の性質の相違を利用して、塩析、等電点沈殿、溶媒による沈殿などの方法で抽出液を分別し、目的とするタンパク質画分(含む部分)をさらに超遠心沈殿、イオン交換クロマトグラフィー、ゲル濾過、アフィニティクロマトグラフィー(生体物質の示す特異的な相互作用を利用したクロマトグラフィー。酵素の精製には基質の類似物質や抗体を、抗体の精製には抗原ペプチドなどを支持体に結合する)、電気泳動、等電点電気泳動などの手段を組み合わせて精製する。結晶化可能な場合には結晶として得る。収率よく得るためには、操作段階を少なく、特異的に得る方法(アフィニティクロマトグラフィーなど)を用いるのが有効である。1990年ごろからは、遺伝子工学的手法を用いて当該タンパク質のmRNA(メッセンジャーRNA)またはcDNA(相補的DNA=complementaryDNAの略。mRNAを鋳型として逆転写酵素によって合成された、鋳型RNAと相補的な塩基配列をもつ1本鎖DNA)を発現させ、発現タンパク質から簡便に精製する方法もとられている。とくに微量なタンパク質の精製に有効である。得られたタンパク質の純度は、生物学的活性、超遠心分析、SDS‐ゲル電気泳動、抗原抗体反応などによりごく微量で検定される。
[内田庸子]
化学合成
一定配列のタンパク質の合成法としては、液相法と固相法の2方法がおもに使われている。
(1)液相法 カルボキシ基(カルボキシル基)を保護したアミノ酸にアミノ基を保護したアミノ酸を縮合させ、生じたペプチドのアミノ基の保護を外して次のアミノ基保護アミノ酸を縮合させるという方法で、C末端からN末端に向かって一つずつ延長していく。この方法は確実ではあるが手数がかかり、あまり長いペプチドは合成できない。
(2)固相法 1963年メリフィールドによりペプチド合成法として開発された。C末端の保護基として不溶性高分子担体(支持体)を用い、これにアミノ基を保護したアミノ酸を順次ジシクロヘキシルカルボジイミド(DCC、縮合剤)法で延長させていき、最終的に生じたペプチドをフッ化水素で樹脂から切り離し、得られたペプチドを高速逆相クロマトグラフィーなどで精製する。1990年ごろからはこの方法に基づくペプチド合成機の開発により迅速に数十残基のペプチドが合成されるようになった。(1)と(2)の方法で得られた部分ペプチドを化学的に(たとえばDCC)結合させて完全タンパク質を合成することができる。これまでにインスリン、リボヌクレアーゼA、リボヌクレアーゼT1などが完全合成されている。
化学合成は構造の確認、構造と機能の相関関係の解明などに利用されてきた。1990年ごろからはタンパク質分子の表面に出ていると思われるペプチドを合成して、それに対する抗体を作製することができるようになった。その抗体が天然タンパク質と特異的に反応する場合に限り、mRNA(メッセンジャーRNA)の取得や、遺伝子工学で合成されたタンパク質の精製などに使用される。
[内田庸子]
生合成
細胞内でタンパク質は遊離アミノ酸からDNA中に保存されている遺伝情報を正確に翻訳して生合成される。生合成は膜結合型あるいは遊離型リボソーム(リボゾーム、実際にはポリソームを形成している)の上で行われる。その反応過程は次に述べる4段階からなっている。
(1)アミノ酸の活性化 20種の遊離アミノ酸は、それぞれのアミノ酸に対するアンチコドンを保有している特異的なtRNA(転移RNA)の3'-末端のリボースに、ATP(アデノシン三リン酸)とMg2+存在下で、アミノアシルtRNA合成酵素(アミノアシルtRNAシンテターゼ)の作用により、エステル結合で結合されてアミノアシルtRNAとなる。
(2)ペプチド鎖合成の開始 DNAのもつ遺伝情報をそのまま転写して生じたmRNAと、開始コドン(AUG、メチオニンのコドン)に対応するN-ホルミルメチオニンtRNA(原核細胞)または開始メチオニンtRNA(真核細胞)が、リボソームの小サブユニットと結合し、その上にさらにリボソームの大サブユニットが加わってタンパク合成の開始複合体が形成される。開始複合体の形成には多くの開始因子(IF)とGTP(グアノシン三リン酸)やMg2+が関与しており、その機構は原核細胞と真核細胞で多少異なり、後者ではATPも必要とされている。いずれの場合も、開始コドンに対応するアミノアシルtRNAはリボソーム上の三つのtRNA結合部位(E部位、P部位、A部位)のうちのP部位に結合される。
(3)ペプチド鎖の延長 mRNA中の第二のコドンによって決定される第二のアミノ酸のついたアミノアシルtRNA2(aa2-tRNA2)が、ポリペプチド鎖延長因子(EF-Tu-GTP)、Mg2+の存在下で開始複合体のA部位に結合する。ついでリボソームの大サブユニット中に存在するrRNAによるペプチジルトランスフェラーゼ(リボザイム、RNA酵素)の作用で、P部位にあるaa1-tRNA1についている第一のアミノ酸が第二のアミノ酸(aa2)のアミノ基に転移されてペプチド結合を形成する。次に、別のタンパク性因子(EF-G-GTP)、Mg2+の存在下でリボソームはmRNA上で1コドン分(3塩基分)だけ転座し、その結果、新生ペプチドをもったtRNA2(aa1-aa2-tRNA2)はA部位からP部位に移り、第一のアミノ酸を失ったtRNA1はE部位に移り、リボソームから遊離される。次にA部位には第三のコドンに相当するaa3-tRNA3が結合され、同じ反応が繰り返される。すなわち、ポリペプチド鎖はそのカルボキシ末端に一つずつアミノ酸を付加しながら延長していき、できたばかりの新生ペプチド鎖は最後のアミノ酸tRNAに結合してP部位に存在していることになる。
(4)ペプチド鎖合成の終結 リボソーム上のA部位に終止コドンが出現すると、終結因子がこれを認識して結合し、P部位に結合しているペプチジルtRNAのポリペプチド鎖とtRNAの間のエステル結合が大サブユニット内のrRNAのペプチジルトランスフェラーゼ作用によって加水分解され、ポリペプチド鎖が遊離する。終止コドンとしてはUAA、UAG、UGAの3種がある。原核細胞の終結因子には、UAAとUAGを認識するRF-1、UAAとUGAを認識するRF-2、この二つの因子の機能を促進するRF-3の3種がある。真核細胞では、すべての終止コドンを認識するeRFと、その作用を促進するS因子が知られている。ポリペプチド鎖の遊離後、リボソームに残ったmRNA、tRNAも遊離され、リボソームはモノソーム(run off型)となり、さらに大小のサブユニットに解離して次のポリペプチド鎖合成に利用される。
こうして得られた新生ポリペプチド鎖が細胞の構成成分として有用な機能性タンパク質となるには、正しく-S-S-架橋を形成し三次元的に折り畳まれて特有の高次構造を形成し(フォールディング)、翻訳後修飾を受けて特定の機能を獲得し、その機能を発揮する場所へ正しく運ばれる(ソーティング、または局在化)ことが必要である。翻訳後修飾は、-S-S-結合の架橋をはじめとするアミノ酸側鎖のさまざまな化学修飾と、ポリペプチド鎖の特異的切断を含んでいる。前者にはリン酸化、メチル化、アデニリル化、ADPリボシル化、ミリストイル化、糖鎖の付加(グリコシル化)、N末端アミノ酸のブロック(アシル化)、などが知られている。後者には、新生タンパク質のシグナルペプチドの切断、前駆体タンパク質の限定分解によるホルモンや生理活性ペプチドの生成、などがあげられる。実際に新生ポリペプチド鎖がどこでどのような修飾を受けるかはそれぞれのタンパク質によって異なり、局在化の過程と関連している。
タンパク質生合成の阻害剤としては、ペプチド転移反応の受容体であるアミノアシルtRNAを拮抗(きっこう)的に阻害するピューロマイシン、リボソームの小サブユニットに結合するストレプトマイシン、アミノアシルtRNAがA部位に入ることを阻止してポリペプチド鎖の延長を阻害するテトラサイクリン、大サブユニットに存在するrRNAのペプチジルトランスフェラーゼ作用を阻害するクロラムフェニコールやシクロヘキサミド、大サブユニットに結合してリボソームの転座を阻害するエリスロマイシン、同じく転座を阻害するフシジン酸などが知られている。
タンパク質合成の調節機構はたいへん複雑である。原核細胞では、おもにプロモーター部位での転写開始の頻度の調節により制御されている。真核細胞とくに多細胞生物ではさらに複雑で、ホルモンは重要な調節因子である。
[内田庸子]
局在化
タンパク質はそのアミノ酸配列中にその行き先を示す選別シグナル配列をもっている。真核細胞ではそのシグナルにしたがって各細胞内小器官、核、ミトコンドリア、葉緑体(植物)、ペルオキシソーム(一層の膜に囲まれた細胞内小器官。有毒分子の酸化を行うための隔離された場所)、小胞体へと運ばれていく。一例をあげれば、結合型ポリリボソームで合成される分泌タンパク質や膜タンパク質は、そのN末端に存在するシグナル配列を認識する識別粒子(SRP)により小胞体膜上の輸送チャンネルに誘導され、小胞体内腔(ないこう)に送り込まれる。合成終了とともに小胞体内部のシグナルペプチダーゼでシグナルペプチドが切断されて小胞体内腔に放出される。新生タンパク質は-S-S-架橋の形成、糖鎖の付加など小胞体特有の化学修飾を受け、さらに小胞体内の分子シャペロンの介助で正しい高次構造に折り畳まれる。この際、誤ってフォールディングしたタンパク質やストレスによる変性タンパク質が小胞体内に蓄積することがある。その場合は、小胞体内の分子シャペロンの発現増量、新たな新生タンパク質の翻訳抑制などで小胞体内を調整するとともに、変性タンパク質をサイトゾルに引き出し、後述のユビキチン‐プロテアソーム系で分解して除去する。正しくできあがったタンパク質はゴルジ体に送られ、種々の修飾酵素によりさらに糖鎖、リン脂質が付加されるなどにより選別操作がより進められ、リソソーム、細胞膜、細胞外へとそれぞれ輸送されていく。原核細胞でも、細胞膜や細胞膜外で機能するタンパク質はシグナルペプチドをもち、同様の機構で膜を通過していく。ミトコンドリア(葉緑体)内膜で機能するタンパク質は遊離型リボソームで前駆体として合成されるが、N末端にやはり特有のシグナル配列をもつ。分子シャペロン(HSP70)とATPの介助で高次構造を崩し、内膜、外膜の二重層膜を透過する。ミトコンドリア内のペプチダーゼでシグナル配列除去後、内部に存在する分子シャペロン(HSP60)により複合体の高次構造に組み込まれる。
[内田庸子]
タンパク質の寿命と分解
生体内ではタンパク質の合成と分解が絶えずおこっていて、動的平衡状態にある。しかし、細胞内タンパク質の寿命は数分から200時間以上のものまで千差万別である。一般に酵素や、細胞内で制御的機能を果たすタンパク質は短寿命(半減期2時間以内)であり、細胞の構造を維持するタンパク質、解糖系の酵素などは長寿命である。
短寿命のタンパク質は代謝回転が速く、合成や分解の速度の変化に応じてタンパク量をすばやく変化しうるので刺激に応じた生体反応を行うことができる。短寿命のタンパク質の多くはユビキチン(真核生物に普遍的に存在する、アミノ酸76個からなるタンパク質)化されて不用タンパク質の標識をつけられてから26s(s=スベドベリSvedberg unitは沈降係数の単位で、26sはスベドベリ単位で示した分子量)のプロテアソーム(プロテアゾーム)で分解される。1990年代後半以降、多様なユビキチンシステムがみいだされてきており、多様な標的分子に自在に対処できることを示している。標的分子としては細胞周期の制御因子、物質代謝の律速酵素、シグナル伝達因子、転写因子、癌(がん)および癌抑制遺伝子産物、ポリペプチドレセプターなどますます増加の一途をたどっている。このタンパク質分解系では、ユビキチンシステムも26sプロテアソーム(分子量約200万)もATP依存性で代謝エネルギーを必要とする。このプロテアソーム系は変異、障害タンパク質または小胞体や細胞質ゾルで正常なフォールディングや分子集合のできなかった異常タンパク質の除去(タンパク質の品質管理機構)にも関与している。
生体タンパク質の約2分の1はリソソーム(リソゾーム)系で分解される。超寿命タンパク質や膜タンパク質のなかで、細胞外に存在する外来性タンパク質(ペプチドホルモンや成長因子、アルブミンや低比重リポタンパク質、外来性異物など)は、エンドサイトーシス(細胞外から細胞内へ物質の取り込まれる機構)の経路でリソソームに取り込まれる(異食作用=ヘテロファジー)。内在性タンパク質はリソソームの膜を通して取り込まれる(自食作用=オートファジー)。両タンパク質とも、リソソーム中に含まれるタンパク分解酵素(プロテアーゼ)、カテプシン群(B.C.H.K.L.S.D)により分解される。リソソームにはカテプシンを中心としたプロテアーゼのほかに、糖質分解酵素、脂質分解酵素、核酸分解酵素など各種加水分解酵素が存在し、すべての生体物質を分解することができる。リソソーム系の分解は細胞質のさまざまな成分を非選択的に分解するシステムである。動物の場合、内在性タンパク質の分解は細胞外のアミノ酸レベルにより調節される。
動物の場合はさらに、外から摂取したタンパク質を分解して栄養的に必須(ひっす)なアミノ酸を供給している。このような目的のタンパク質の消化は、原生動物ならば壁に囲まれた消化用の空胞、哺乳(ほにゅう)動物ならば胃腸管の内腔(ないこう)というように、動物自身の細胞内容物から隔離されたところで行われている。また分解酵素はすべて不活性なチモーゲンとして合成分泌され、胃腸管の内腔で活性化される。それぞれ基質特異性を異にする多種類のプロテアーゼ(ペプシン、トリプシン、キモトリプシンなど)、ペプチダーゼ、エキソペプチダーゼ(ロイシンアミノペプチダーゼ、カルボキシペプチダーゼAおよびBなど)の相補的相互作用によってほぼ完全にアミノ酸まで分解し、吸収される。
[内田庸子]
栄養
タンパク質が体内で利用される経路を考えてみよう。食物のタンパク質はアミノ酸に消化・分解されて体内に吸収され、代謝され、利用される。したがって、タンパク質を摂取することの栄養上の意味はアミノ酸を摂取することにあり、体内のアミノ酸プール(体内の血液・臓器などに含まれるアミノ酸の存在状態)の正常なバランスを保つことにある。体内のタンパク質はつねに合成と分解を繰り返して新しくつくりかえられている。その分解で生じたアミノ酸は再合成の素材として再利用されるが、その利用効率は100%ではない。遊離アミノ酸の一部は不可逆的に酸化され体外に排泄(はいせつ)されるので、食物として補給される必要がある。
タンパク質は糖質におけるグリコーゲンのような貯蔵用の分子形態をもたないので、必要量以上に摂取しても余分の窒素は尿素として尿へ排泄されてしまう。さらに、タンパク質の過剰摂取はカルシウムの尿への排泄を増大させ(骨粗鬆症(こつそしょうしょう)の可能性)、腎障害を招く可能性もある。逆に、食物としての摂取タンパク質が不足すると主に体内の筋タンパク質を分解して必要量のアミノ酸を供給することとなる。したがって、タンパク質は毎日食物から摂取する必要があり、ヒトの栄養に欠かせない物質である。
[内田庸子]
タンパク質の所要量
タンパク質の必要量は窒素出納法(摂取窒素量と排出窒素量の差を測定する)の結果に基づいて算定されている。成人では摂取した窒素量と排出される窒素量はほぼ等しい。つまり窒素平衡が保たれている。しかし、無タンパク質食を摂取した場合は窒素排出量はある一定量(4グラム)以下には減少せず、窒素平衡は成立しない。窒素平衡を維持するために必要な量をそのタンパク質の必要量としている。
良質タンパク質を用いた時の窒素平衡維持に必要な量は、0.70g/kg/日(体重1キログラム当り、タンパク質1日0.70グラム)と算定された。この値には人種差があるという証拠もなく、性差に関しても報告はない。現在、日本人の日常摂取混合タンパク質の質は良好で、良質タンパク質と差はないとされたが、利用効率は若干劣り90%と見積もられた。良質タンパク質の窒素平衡維持量の測定時の個人差に対する安全率は30%とみなした。これらの安全率を考慮して、日本人の成人(18~69歳)のタンパク質所要量は、0.70×(100/90)×1.3を各年齢の平均体重に乗じて求められる(2000年、「第六次改定日本人の栄養所要量」厚生省、現厚生労働省)。その結果、タンパク質所要量は日本人の成人男子で1日70グラム、女子で55グラムであるが、成長期では窒素平衡維持のほかに窒素蓄積の必要があり、12~14歳児では男子で1日85グラム、女子で70グラムである。同じように窒素蓄積を必要とする妊娠期、授乳のためのタンパク質付加を必要とする授乳期、生理機能の低下する高齢者についてもそれぞれタンパク質所要量が算定されている。
[内田庸子]
食品タンパク質の栄養価
食品のタンパク質は種類によってかなりの違いがある。一般に植物性タンパク質より動物性タンパク質、たとえば全卵、畜肉、魚肉、牛乳などのタンパク質の栄養価が高い。植物性タンパク質中では、大豆(豆腐、納豆)、米のタンパク質が高く、小麦はこれらより劣る。食品によってタンパク質の栄養価が異なるのは、そのタンパク質に含まれている不可欠アミノ酸の量とバランスに違いがあるためである。食品タンパク質では、不可欠アミノ酸の大部分がその必要量を満たしていても、一つでも必要量以下のものがあれば体内でのタンパク質の合成は制限されてしまう。それで摂取した不可欠アミノ酸のうちでもっとも不足するものを第一制限アミノ酸という。1985年国際機関(FAO=国連食糧農業機関、WHO=世界保健機関、UNU=国連大学)によってヒトの不可欠アミノ酸の理想的な含量を示すアミノ酸パターンが策定された。このアミノ酸パターンと、各食品タンパク質の不可欠アミノ酸の組成を比較することによりそのタンパク質の質、栄養価を表すことができる。良質タンパク質の代表とされる全卵タンパク質は全不可欠アミノ酸含量がこの値を超えるが、白米タンパク質の第一制限アミノ酸はリジンで理想アミノ酸含量の62%である。これを100倍した値は「アミノ酸価(アミノ酸スコア)」とよばれ、食品タンパク質の栄養価の化学的評価法として用いられている。良質タンパク質は100、白米は62、小麦粉は39と表される。
栄養価の劣るタンパク質に不足するアミノ酸を補うと栄養価は向上する。いくつかの食品を組み合わせることにより不足するアミノ酸を互いに補い栄養価をあげることができる(アミノ酸の補足効果)。たとえば、主食の米に副食として大豆を組み合わせると、米に不足するリジンを大豆が補い、大豆に不足するメチオニンを米が供給するので、同時に両者を摂取すると栄養価が高くなる。動物性タンパク質の不可欠アミノ酸組成はヒトのアミノ酸パターンに近く(アミノ酸価100)、植物性タンパク質より良質である。動物性タンパク質比率が35%以下になるとアミノ酸価は100を切る。動物性タンパク質比率を40%以上に保てばタンパク質の質が問われることはない。しかし動物性タンパク質を多くとると動物性脂質の過剰摂取を招きやすい。その比率を40~50%に保つと、日常摂取混合タンパク質の質を確保し、飽和脂肪酸の過剰摂取を回避し、同時にビタミンやミネラル(カルシウム、鉄など)の補給にも好都合である。
食品タンパク質の栄養価を表す方法はほかにもいくつか知られている。吸収された窒素量と体内に保留された窒素量の比率で表す生物価、摂取した窒素量と保留された窒素量の比率で表す正味タンパク質利用効率(NPU)、摂取タンパク質量と体重増加量の比率で表すタンパク質効率(PER)などがある。
[内田庸子]
『宇井信生編『タンパク質の化学1』』▽『成田耕造編『タンパク質の化学2、4』』▽『今掘和友編『タンパク質の化学3』(1976~1977・以上東京化学同人)』▽『赤堀四郎・中川八郎編『タンパク質栄養』(1978・講談社)』▽『矢原一郎ほか編『タンパク質に魅せられて――今堀和友の研究遍歴』(1981・学会出版センター)』▽『蛋白質研究奨励会編『タンパク質――生命を担うこの身近で不思議な物質』(1983・東京化学同人)』▽『佐藤了編『タンパク質のふしぎ――この物質が生命のすべてを担う』(1987・読売新聞社)』▽『山内文男著『食品タンパク質の科学――タンパク食品の製造と利用編』(1987・食品資材研究会)』▽『勝部幸輝編『タンパク質3 生物編』(1987・東京化学同人)』▽『勝部幸輝編『タンパク質2 構造と機能編』(1988・東京化学同人)』▽『日本生化学会編『新生化学実験講座第1巻 タンパク質1~7』(1990~1993・東京化学同人)』▽『真鍋敬著『タンパク質のゲル電気泳動法』(1991・広川書店)』▽『高橋礼子著『糖タンパク質と糖結合タンパク質』(1992・広川書店)』▽『鈴木紘一・伊藤菁莪編『タンパク質工学 基礎と応用』(1992・丸善)』▽『Carl Brandenほか著、勝部幸輝ほか訳『タンパク質の構造入門』(1992・教育社)』▽『堀勝治著『アイソザムの分子生物学――酵素・タンパク質の分子多様性を生み出すメカニズムと機能を探る』(1994・共立出版)』▽『菊池栄一編著『動物タンパク質食品』(1994・朝倉書店)』▽『日本蚕糸学会出版委員会監修、小松計一著『シルクへの招待』(1997・サイエンスハウス)』▽『藤田千枝編、川口啓明・菊地昌子・文『遺伝子ゲームがはじまった』(1998・大月書店)』▽『石井裕子著『栄養ハンドブック』(1998・保育社)』▽『泉屋信夫ほか著『生物化学序説』(1998・朝倉書店)』▽『村松正実編著『分子生物学』(1998・朝倉書店)』▽『三浦謹一郎編『構造生物学』(1998・朝倉書店)』▽『嶋本伸雄・日本生物物理学会ほか編『遺伝子の構造生物学』(1998・共立出版)』▽『上代淑人・村松正実編『岩波講座 現代医療の基礎1 分子・細胞の生物学1』(1998・岩波書店)』▽『佐藤衛著『タンパク質のX線解析』(1998・共立出版)』▽『飯盛和代ほか著『食品学実験ノート』(1998・建帛社)』▽『中村和行・高橋進著『生きもののからくり――分子から生命まで』(1998・培風館)』▽『P・M・ゲイマンほか著、中浜信子監修、村山篤子・品川弘子訳『食物科学のすべて』(1998・建帛社)』▽『中束美明著『生命の科学――細胞の分子的理解』(1998・培風館)』▽『片岡栄子ほか編著『栄養学・食品学を学ぶヒトのための食品化学実験』(1998・地人書館)』▽『津田道雄著『生化学――人体の構造と機能』(1998・金原出版)』▽『日本食品科学工業会監修、河村幸雄・大久保一良編『ダイズのヘルシーテクノロジー』(1998・光琳)』▽『岡田雅人・宮崎香編『タンパク質実験の進めかた』(1998・羊土社)』▽『米田悦啓著『核と細胞質の対話』(1998・共立出版)』▽『石浦章一著『タンパク質の反乱――病気の陰にタンパク質の異常あり』(1998・講談社)』▽『糸川嘉則・柴田克己編『栄養学総論』(1998・南江堂)』▽『鈴木敦士ほか編『タンパク質の科学』(1998・朝倉書店)』▽『立石潤著『プリオンとプリオン病』(1998・共立出版)』▽『田村哲彦・上村泰子著『骨粗鬆症を防ぐバランス献立集』(1999・新星出版社)』▽『石嶌純男・大西正健著『細胞高分子学』(1999・学会出版センター)』▽『藤本大三郎著『コラーゲン物語』(1999・東京化学同人)』▽『丸山工作著『生化学入門』(1999・裳華房)』▽『テッド・ゲーツェルほか著、石館康平訳『ポーリングの生涯――化学結合・平和運動・ビタミンC』(1999・朝日新聞社)』▽『日本水産学会監修、西田清義編『魚貝類筋肉タンパク質――その構造と機能』(1999・恒星社厚生閣)』▽『木村光編『ゲノム微生物学』(1999・シュプリンガー・フェアラーク東京)』▽『岡田雅人・宮崎香編『タンパク質実験ノート(上) 抽出と分離精製』『タンパク質実験ノート(下) 分離精製から一次構造の決定まで』(1999・羊土社)』▽『前野正夫・磯川桂太郎著『はじめの一歩のイラスト生化学・分子生物学――生物学を学んでない人でもわかる目で見る教科書』(1999・羊土社)』▽『池内俊彦著『生命を学ぶ――タンパク質の科学』(1999・オーム社)』▽『後藤佐多良編著『病態生化学』(1999・朝倉書店)』▽『山本幸男ほか著『生物科学総説』(1999・理工学社)』▽『左右田健次ほか著『タンパク質――科学と工学』(1999・講談社)』▽『林淳三・高橋徹三著『新栄養士課程講座 栄養学総論』(1999・建帛社)』▽『遠藤克己著『栄養の生化学1・2・3』(1999・南江堂)』▽『日本栄養・食糧学会監修、菅野道広・尚弘子編『大豆タンパク質の加工特性と生理機能』(1999・建帛社)』▽『永山国昭著『生命と物質――生物物理学入門』(1999・東京大学出版会)』▽『室伏きみ子・小林哲幸著『やさしい細胞の科学』(1999・オーム社)』▽『柳田充弘ほか編『分子生物学』(1999・東京化学同人)』▽『George Malacinskiほか著、川喜田正夫訳『分子生物学の基礎』(1999・東京化学同人)』▽『日本化学会編、大場茂・矢野重信編著『X線構造解析』(1999・朝倉書店)』▽『Peck Ritter著、須藤和夫ほか訳『リッター生化学』(1999・東京化学同人)』▽『高橋幸資・和田敬三編『新食品学実験法』(1999・朝倉書店)』▽『駒野徹・酒井裕著『ライフサイエンスのための分子生物学入門』(1999・裳華房)』▽『小長谷明彦著、情報処理学会編『遺伝子とコンピュータ――生命の設計図をひもとく』(2000・共立出版)』▽『南原利夫監修、飯田隆著『ライフサイエンス有機化学――立体化学・生体分子・物質代謝』(2000・共立出版)』▽『大久保岩男ほか編『コンパクト生化学』(2000・南江堂)』▽『菅野純夫・平野久監修『より高感度・定量的な検出解析のための電気泳動最新プロトコール――汎用操作からゲノミクスとプロテオミクスまで対応!』(2000・羊土社)』▽『吉田昭編著、宮田富弘ほか著『レクチャー栄養学総論――第6次改定日本人の栄養所要量準拠』(2000・建帛社)』▽『北岡正三郎著『入門栄養学』(2000・培風館)』▽『渡辺篤監修『豆の事典――その加工と応用』(2000・幸書房)』▽『野口忠ほか著『最新栄養学』(2000・朝倉書店)』▽『野口忠ほか編著『タンパク質代謝研究法』(2000・学会出版センター)』▽『健康・栄養情報研究会編『第六次改定 日本人の栄養所要量――食事摂取基準の活用』(2000・第一出版)』▽『日本生化学会編『タンパク質1 検出・構造解析法』『タンパク質2 機能・動態解析法』(2001・東京化学同人)』▽『月原富武・酒井宏明著『タンパク質の姿、形とその働き』(2001・大阪大学出版会)』▽『杉山政則・滝澤昇著『遺伝子とタンパク質の分子解剖 ゲノムとプロテオームの科学』(2001・共立出版)』▽『香川靖雄・野沢義則著『ナースのための生化学・栄養学』第3版(2001・南山堂)』▽『ロジャー・H・ペーン著、崎山文夫監訳『タンパク質のフォールディング』第2版(2002・シュプリンガー・フェアラーク東京)』▽『岡本進・岡本祐幸著『生体系のコンピュータ・シミュレーション――タンパク質の構造をどこまで予測できるか』(2002・化学同人)』▽『大島泰郎ほか編『ポストシークエンスタンパク質実験法1 全タンパク質の解析』『ポストシークエンスタンパク質実験法2 試料調整法』『ポストシークエンスタンパク質実験法3 構造・機能解析の基礎』(2002・東京化学同人)』▽『中野明彦・遠藤斗志也編『タンパク質の一生――タンパク質の誕生、成熟から死まで』(2002・共立出版)』▽『平山令明著『分子レベルで見た体のはたらき――いのちを支えるタンパク質を視る』完全版(2003・講談社)』▽『竹縄忠臣著『タンパク質実験ハンドブック――分離・精製、質量分析、抗体作製、分子間相互作用解析』『タンパク質がわかる』(2003・羊土社)』▽『ゲーリー・ウォルシュ著、平山令明ほか訳『タンパク質ハンドブック』(2003・丸善)』▽『吉田勉編著『基礎栄養学』(2003・医歯薬出版)』▽『William H. Elliottほか著、清水孝雄・工藤一郎訳『エリオット生化学・分子生物学』(2003・東京化学同人)』▽『真部孝明著『フローチャートで見る食品分析の実際――植物性食品を中心に』(2003・幸書房)』▽『田川邦夫著『からだの働きから見る代謝の栄養学』(2003・タカラバイオ、丸善発売)』▽『吉田勉編著、藤森泰ほか著『基礎からの生化学』(2003・学文社)』▽『西川善之・灘本知憲編『新食品・栄養学シリーズ 栄養学総論』(2003・化学同人)』▽『松本孝芳著『コロイド科学のためのレオロジー』(2003・丸善)』▽『Bruce Albertsほか著、中村桂子・藤山秋佐夫・松原謙一監訳『Essential細胞生物学』第6刷(2003・南江堂)』▽『林淳三編著、木元幸一ほか著『基礎栄養学』(2003・建帛社)』▽『丸山工作・丸山敬著『生命科学入門』(2003・東京教学社)』▽『池内俊彦著『タンパク質の生命科学』(中公新書)』